
【题目】将一小块钠投入到下列溶液中,既能生成气体,又能生成蓝色沉淀的是( )
A.氯化镁溶液B.氢氧化钡溶液C.硫酸铜溶液D.氯化钙溶液
科目:高中化学 来源: 题型:
【题目】只由两种元素组成的化合物,其中一种元素是氢元素,这类化合物称氢化物。下列物质不属于氢化物的是( )
A.HCHOB.PH3C.NaHD.HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期元素A、B、C、D、E、F原子序数依次递增。已知:A、B、D、C的价电子数依次增多,A、B、C同周期且C是该周期中电负性最大的元素;A有两个单电子,E的未成对电子数是前四周期中最多的,且其价电子数与D相同, F的最外层电子数为2,内层全部排满。请用对应的元素符号回答下面的问题:
(1)写出E的价电子排布式:______________。
(2)在A形成的化合物中,A采取sp2杂化,且分子量最小的化合物为(写化学式)______________。
(3)下列物质的性质与氢键有关的是______________。
A. 可燃冰的形成 B. A的氢化物的沸点 C. B的氢化物的热稳定性
(4)E3+可以与AB—形成配离子,其中E3+以d2sp3方式杂化,杂化轨道全部用来与AB—形成配位键,则E3+的配位数为______________,1mol该配离子中含有______________molσ键。
(5)F与D形成的化合物晶胞如图,F的配位数为______________,晶体密度为a g/cm3,NA为阿伏加德罗常数,则晶胞边长为______________pm。(1pm=10-10cm)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟他胺G是一种可用于治疗肿瘤的药物。实验室由芳香烃A制备G的合成路线如下:

回答下列问题:
(1)A的结构简式为____________。C的化学名称是______________。
(2)③的反应试剂和反应条件分别是____________________,该反应的类型是__________。
(3)⑤的反应方程式为_______________。吡啶是一种有机碱,其作用是____________。
(4)G的分子式为______________。
(5)H是G的同分异构体,其苯环上的取代基与G的相同但位置不同,则H可能的结构有______种。
(6)4-甲氧基乙酰苯胺(![]() )是重要的精细化工中间体,写出由苯甲醚(
)是重要的精细化工中间体,写出由苯甲醚(![]() )制备4-甲氧基乙酰苯胺的合成路线___________(其他试剂任选)。
)制备4-甲氧基乙酰苯胺的合成路线___________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】强酸与强碱的稀溶液发生中和反应的热效应为H+(aq)+OH(aq)![]() H2O(l) ΔH=57.3 kJ/mol。稀醋酸、浓硫酸、稀硝酸分别与0.1 mol·L1的NaOH溶液恰好完全反应,放出的热量与消耗NaOH溶液的体积之间的关系如图所示(CH3COOH电离要吸热)。则下列描述正确的是
H2O(l) ΔH=57.3 kJ/mol。稀醋酸、浓硫酸、稀硝酸分别与0.1 mol·L1的NaOH溶液恰好完全反应,放出的热量与消耗NaOH溶液的体积之间的关系如图所示(CH3COOH电离要吸热)。则下列描述正确的是

A.A表示稀硝酸与NaOH溶液的反应
B.B表示稀醋酸与NaOH溶液的反应
C.b=5.73
D.C表示浓硫酸与NaOH溶液的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置能达到相应目的的是( )
A | B | C | D | |
实验装置 |
|
|
|
|
目的 | 验证Fe与稀盐酸反应放热 | 测定中和热 | 制备干燥的NH3 | 分离I2和NH4Cl |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2CO3溶液与盐酸反应过程中的能量变化示意图如图,下列反应属于吸热反应的是( )
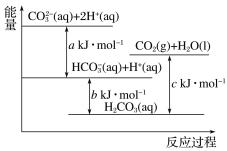
A. CO32-(aq)+H+(aq)=HCO3-(aq)
B. CO32-(aq)+2H+(aq)=CO2(g)+H2O(l)
C. HCO3-(aq)+H+(aq)=CO2(g)+H2O(l)
D. CO2(g)+H2O(l)=H2CO3(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
①H2(g)+1/2O2(g)=H2O(l) ΔH =-285.8 kJ/mol
②H2(g)+1/2O2(g)=H2O(g) ΔH =-241.8 kJ/mol
③C(s)+1/2O2(g)=CO(g) ΔH =-110.5 kJ/mol
④C(s)+O2(g)=CO2(g) ΔH =-393.5 kJ/mol
回答下列问题:
(1)H2的燃烧热ΔH=_______;C的燃烧热为__________。
(2)燃烧1 g H2生成液态水,放出的热量为_________。
(3)已知CO的燃烧热为283.0 kJ/mol,现有CO、H2和CO2组成的混合气体116.8 L(标准状况),完全燃烧后放出总热量为867.9 kJ,且生成18 g液态水,则混合气体中H2为_________L,CO在混合气体中的体积分数约为_________(精确至小数点后一位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E都是短周期元素,原子序数依次增大,A、B处于同一周期,C、D、E同处另一周期。C、B可按原子个数比2∶1和1∶1分别形成两种化合物甲和乙。D、A按原子个数比3∶2形成化合物丙。E是地壳中含量最高的金属元素。根据以上信息回答下列问题:
(1)B元素在周期表中的位置是_________________。
(2)A单质的电子式_________________。
(3)D的简单阳离子的离子结构示意图_________________。
(4)A、B、C、D、E五种元素的原子半径由大到小的顺序是(用元素符号填写)_________。
(5)用电子式表示C2B2的形成过程___________________________________。
(6)写出E的单质与C元素的最高价氧化物对应的水化物反应的离子方程式:____;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com