
【题目】I.现有右图所示裝置,为实现下列实验目的,其中应以a端作为入口的是__________。
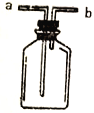
A.瓶内盛碱石灰,用以干燥气体
B.瓶内盛饱和食盐水,用以除去Cl2中混有的少量HCl
C.瓶内盛水,用以测量某难溶于水的气体体积
D.瓶内贮存气体,加水时气体可被排出
E.收集密度比空气大的气体
F.收集密度比空气小的气体
Ⅱ.欲用98%的浓硫酸(密度为1.84g·cm3)配制浓度为1mol/L的稀硫酸480mL。
(1)需取用浓硫酸的体积为______________mL(结果保留一位小数)
(2)下列情况中,会使所配溶液的浓度偏低的是__________。
A.将量筒中的浓硫酸转入烧杯后,用水洗涤量筒,将洗液也转入烧杯中
B.稀释浓硫酸后立即转入容量瓶
C.定容时加水不慎超过刻度线
D.定容时仰视刻度线
(3)容量瓶在使用前,首先应检查___________________。
(4)此实验中,玻璃棒的两个作用分别是_________、_____________________。
【答案】 BDE 27.2 CD 是否漏水(或漏液) 搅拌 引流
【解析】I.A.盛液体干燥剂,用于干燥气体时,要长进短出,但不能盛碱石灰固体干燥剂,A错误;B.瓶内盛液体洗剂,采用长进短出,可以用于除去某气体中的杂质,B正确;C.装置中预先盛满水,将水排出测量气体体积,实际上是排水法收集气体;气体从b端进入后,使瓶内压强增大,从而将其中的水排出瓶外,瓶内便收集到了所需气体,C错误;D.瓶内贮存气体,从a长导管加入水,气体能够从b短导管排出,D正确;E.收集气体从a端进入集气,实际上是向上排空气法收集气体;因此该气体必须具有的性质是:气体的密度比空气的大,E正确;F.根据E可知,从a端进入集气,气体的密度比空气的大,F错误;答案选BDE;
II.(1)配制480mL溶液,应该选用500mL容量瓶;98%的浓硫酸(密度为1.84g·cm3)的物质的量浓度为:1000×1.84×98%/98mol·L-1=18.4mol/L,配制500mL 1mol/L的稀硫酸,需要浓硫酸的体积为:1mol/L×0.5L/18.4mol/L≈0.0272L=27.2mL;(2)A.将量筒中的浓硫酸转入烧杯后,用水洗涤量筒,将洗液也转入在烧杯中,量筒不能洗涤,否则配制的溶液中溶质的物质的量偏大,根据c=n/V可得,配制的溶液浓度偏高,A错误;B.稀释浓硫酸后立即转入容量瓶,热的溶液体积偏大,冷却后溶液的体积偏小,根据c=n/V可得,配制的溶液浓度偏高,B错误;C.定容时加水不慎超过刻度线,导致配制的溶液体积偏大,根据c=n/V可得,配制的溶液浓度偏低,C正确;D.定容时仰视刻度线,导致配制的溶液体积偏大,根据c=n/V可得,配制的溶液浓度偏小,D正确;答案选CD;(3)容量瓶在使用前,首先应检查是否漏水(或漏液)。(4)此实验中,玻璃棒的两个作用分别是稀释时搅拌,转移时引流。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】向100mLNaBr和NaI的混合溶液中缓慢通入适量的Cl2,充分反应后将所得溶液蒸干,并将所得固体灼烧至恒重,得到mg固体。m与通入Cl2的体积[V(Cl2),标准状况]关系如图所示。则下列说法不正确的是
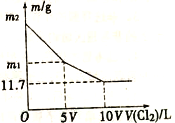
A. V=0.224 B. 混合溶液中:c(Na+)=2 mol/L
C. m2=25.3 D. m1=18.55
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】框图中甲、乙为单质,其余均为化合物,B为常见液态化合物,A为淡黄色固体,F、G所含元素相同且均为氯化物。G遇KSCN溶液显红色。
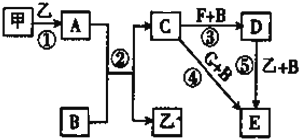
请回答下列问题:
(1)上述5个反应中,既属于氧化还原反应又属于化合反应的是_________________(填序号)。
(2)反应⑤的化学方程式为________________________________。
(3)甲与B反应的离子方程式为________________________________。
(4)在实验室将C溶液滴入F溶液中,观察到的现象是________________________________。
(5)在F溶液中加入等物质的量的A,发生反应的总的离子方程式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的熔沸点高低比较正确的是( )
A.邻二甲苯( ![]() )、邻羟基苯甲醛(
)、邻羟基苯甲醛( ![]() )熔沸点均于其对应对位取代物
)熔沸点均于其对应对位取代物
B.卤素元素的单质及其氢化物的熔沸点随原子半径的增大而升高
C.石墨、金刚石、碳化硅、晶体硅、白磷、水、干冰熔沸点依次降低
D.NaCl、MgCl2、MgO,Al2O3熔沸点依次减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子,能在指定溶液中大量共存的是( )
A.无色溶液中:Na+、MnO4﹣、CO32﹣、Cl﹣
B.能使紫色石蕊试剂变红的溶液中:OH﹣、K+、Ba2+、Na+
C.透明的酸性溶液中:Fe3+、Mg2+、Cl﹣、NO3﹣
D.pH=1的溶液中:NH4+、Fe2+、Cl﹣、NO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸钠(NaA)可用作饮料的防腐剂,研究表明苯甲酸(HA)的抑菌能力显著高于A﹣ , 在生产碳酸饮料的过程中,除了添加NaA外,还需加压冲入CO2气体,已知25℃时,HA、H2CO3的电力平衡常数分别为K=6.25×10﹣5、K1=4.3×10﹣7 , 下列说法正确的是(不考虑饮料中其他成分)( )
A.提高CO2充气压力,饮料中c(A﹣)不变
B.当pH为5.0时,饮料中 ![]() =0.16
=0.16
C.相比于未充CO2的饮料,碳酸饮料的抑菌能力较低
D.结合H+的能力:A﹣>HCO3﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com