
分析 (1)硫酸氢钠足量,离子方程式按照碳酸氢钡的化学式书写,反应生成硫酸钡、硫酸钠、二氧化碳气体和水;
(2)碳酸氢钡足量,离子方程式按照硫酸氢钠的化学式书写,反应生成碳酸氢钠、硫酸钡、二氧化碳气体和水,据此写出反应的离子方程式.
解答 解:(1)足量的NaHSO4溶液与Ba(HCO3)2溶液混合,离子方程式按照碳酸氢钡的化学式书写,反应生成硫酸钡、硫酸钠、二氧化碳气体和水,反应的离子方程式为:,
答:足量的NaHSO4溶液与Ba(HCO3)2溶液混合的离子方程式为Ba2++SO42-+2H++2HCO3-═BaSO4+2H2O+2CO2↑;
(2)足量的Ba(HCO3)2溶液与NaHSO4溶液混合,离子方程式按照硫酸氢钠的化学式书写,反应生成碳酸氢钠、硫酸钡、二氧化碳气体和水,反应的离子方程式为:Ba2++SO42-+H++HCO3-═BaSO4+H2O+CO2↑,
答:足量的Ba(HCO3)2溶液与NaHSO4溶液混合为Ba2++SO42-+H++HCO3-═BaSO4+H2O+CO2↑.
点评 本题考查了离子方程式的书写,题目难度中等,明确反应物过量情况对生成物的影响为解答关键,注意熟练掌握离子方程式的书写原则,试题培养了学生灵活应用基础知识的能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | Ca2+、Cl-、$MnO_4^-$、Na+ | B. | K+、Cl-、$SO_4^{2-}$、H+ | ||
| C. | OH-、Na+、Al3+、I- | D. | H+、Cl-、Ba2+、Ag+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W元素是硅元素 | |
| B. | 气态氢化物的稳定性:Y<R | |
| C. | X、W、Y的最高价氧化物的水化物酸性强弱顺序是X<Y<W | |
| D. | X、Y、W、R的原子半径由大到小的顺序为R>W>X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
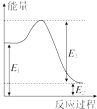 甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料.
甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料.| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能 (kJ•mol-1) | 348 | 413 | 436 | 358 | 1072 | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 原子半径大小为:B>A>C | B. | 核电荷数:D>C>B>A | ||
| C. | A与D形成的化合物均是离子键 | D. | 生成的氢化物的稳定性为:D>A>B |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该反应放出251.2 kJ的热量 | B. | 该反应吸收251.2 kJ的热量 | ||
| C. | 该反应放出125.6 kJ的热量 | D. | 该反应吸收125.6 kJ的热量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com