
| A. | 氯气是氧化剂,FeCl3是还原剂 | |
| B. | 常温下,与56g Fe反应断裂1.5NA个Cl-Cl键 | |
| C. | 1 L 0.1 mol•L-1 FeCl3溶液中含有0.1NA个Fe3+ | |
| D. | 常温常压下,22.4 L Cl2和足量Fe反应转移3NA个电子 |
分析 A.氧化剂化合价降低,还原剂化合价升高;
B.铁与氯气反应生成氯化铁;
C.Fe3+能发生水解;
D.常温常压下,Vm≠22.4L/mol.
解答 解:A.氯气是氧化剂,Fe是还原剂,故A错误;
B.铁与氯气反应生成氯化铁,1mol铁反应1.5mol氯气,则反应断裂1.5NA个Cl-Cl键,故B正确;
C.Fe3+能发生水解,离子个数小于0.1 NA,故C错误;
D.常温常压下,Vm≠22.4L/mol,22.4 L 的Cl2的物质的量不是1mol,故D错误.
故选B.
点评 本题考查阿伏加德罗常数,题目难度不大,注意从物质的组成、结构、性质、聚集状态以及存在的条件是否标准状况等角度思考.


科目:高中化学 来源: 题型:选择题
| W | X | |
| Y | Z |
| A. | X、Y、Z中最简单氢化物稳定性最弱的是Y | |
| B. | Z元素氧化物对应水化物的酸性一定强于Y | |
| C. | X元素形成的单核阴离子还原性强于Y | |
| D. | Z元素单质在化学反应中只表现氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ⑤⑥ | D. | ②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯和甲苯能使溴水褪色,是因为苯和甲苯均能与溴发生加成反应 | |
| B. | 苯和甲苯均可与氢气发生加成反应 | |
| C. | 苯和甲苯均可以与硝酸在一定条件下发生取代反应 | |
| D. | 苯和甲苯能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH小于7的雨水即为酸雨 | |
| B. | 用食醋可除去水壶内壁上的水垢 | |
| C. | 为了除去MgCl2酸性溶液的Fe3+,可在加热搅拌的条件下加入氨水 | |
| D. | 明矾是一种水处理剂,可用于水的杀菌、消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
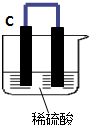 如图所示,将锌、铜通过导线相连置于稀硫酸中.
如图所示,将锌、铜通过导线相连置于稀硫酸中.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com