
【题目】(1)0.5 mol H2O的质量为____________,其中含有_________个水分子,氢原子的物质的量为__________。
(2)质量相同的H2、NH3、SO2、O3四种气体中,含有分子数目最少的是________,在相同温度和相同压强条件下,体积最大的是___________。
科目:高中化学 来源: 题型:
【题目】下列关于原子结构、元素性质的说法正确的是( )
A. 非金属元素组成的化合物中只含共价键
B. ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强
C. 同种元素的原子均有相同的质子数和中子数
D. IA族金属元素是同周期中金属性最强的元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烃A是一种植物生长的调节剂,分子式为C2H4。A进行下图所示的转化可制得有果香味的液体E(C4H8O2),回答下列问题:
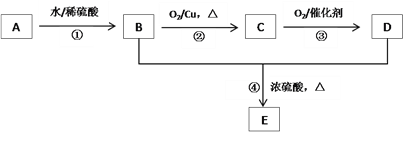
(1)①④反应的类型分别是___________、___________。
(2)反应②的化学方程式为________________________。
(3)实验室由反应④制备E的装置如下图,烧瓶中加入碎片的作用是_____________,长导管的作用是导气和_______,锥形瓶中盛放的液体是_______。
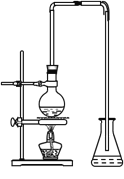
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2015江苏卷】己烷雌酚的一种合成路线如下:

下列叙述正确的是( )
A.在NaOH水溶液中加热,化合物X可发生消去反应
B.在一定条件,化合物Y可与HCHO发生缩聚反应
C.用FeCl3溶液可鉴别化合物X和Y
D.化合物Y中不含有手性碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧化铝是治疗胃酸过多的胃药的主要成分,目前已不常用,其原因是 ( )
A.长期摄入不利于人体健康
B.它不能中和胃酸
C.它不易溶于胃液
D.它的疗效较差
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①![]() ;
;
② 苯环上原有的取代基对新导入的取代基进入苯环的位置有显著影响。
以下是用苯作原料制备一系列化合物的转化关系图:

(1)A转化为B的化学方程式是_________________________。
(2)图中“苯→①→②”省略了反应条件,请写出①、②物质的结构简式:
①________________,②____________________。
(3)苯的二氯代物有__________种同分异构体。
(4)有机物 的所有原子_______(填“是”或“不是”)在同一平面上。
的所有原子_______(填“是”或“不是”)在同一平面上。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在无色、酸性溶液中能大量共存的一组离子是( )
A.Ca2+、Na+、SO42-、MnO4-
B.K+、Fe2+、SO42-、HCO3-
C.Ba2+、K+、Mg2+、Cl-
D.Na+、Na+、ClO-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年全国各地雾霾严重,为有效控制雾霾,各地积极采取措施改善大气质量。研究并有效控制空气中氮氧化物、碳氧化物等污染物是一项重要而艰巨的工作。
Ⅰ.氮氧化物的研究
(1)一定条件下,将2mol NO与2mol O2置于恒容密闭容器中发生反应:2NO(g)+O2(g) ![]() 2NO2(g),下列状态能说明该反应达到化学平衡的是(_______)
2NO2(g),下列状态能说明该反应达到化学平衡的是(_______)
A.混合气体的密度保持不变
B.NO的转化率保持不变
C.NO和O2的物质的量之比保持不变
D.O2的消耗速率和NO2的消耗速率相等
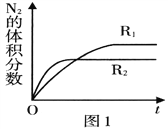
(2)已知反应. 2NO(g) ![]() N2(g)+O2(g) ΔH<O,在不同条件时N2的体积分数随时间(t)的变化如图1所示。根据图象可以判断曲线R1、R2对应的下列反应条件中不同的是______ (填字母序号)。
N2(g)+O2(g) ΔH<O,在不同条件时N2的体积分数随时间(t)的变化如图1所示。根据图象可以判断曲线R1、R2对应的下列反应条件中不同的是______ (填字母序号)。
A.压强 B.温度 C.催化剂
根据图2中的能量变化数据.计算反应2NO(g) ![]() N2(g)+O2(g)的ΔH=__________
N2(g)+O2(g)的ΔH=__________
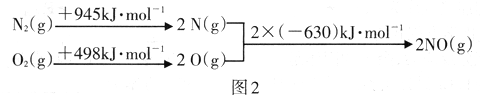
Ⅱ.碳氧化物研究
(3)CO和H2在一定条件下可以合成甲醇:CO(g)+2H2(g) ![]() CH3OH(g) ΔH<O ,现在体积为1L的恒容密闭容器(图3甲)中通入1mol CO和2mol H2,测定不同时间、不同温度(T)下容器中CO的物质的量,如下表:
CH3OH(g) ΔH<O ,现在体积为1L的恒容密闭容器(图3甲)中通入1mol CO和2mol H2,测定不同时间、不同温度(T)下容器中CO的物质的量,如下表:

请回答:
①T1_____ T2(填“>”或“<”或“=”),理由是____________________。已知T2℃时,第20min时容器内压强不再改变,此时H2的转化率为_________,该温度下的化学平衡常数为________ 。
②若将1mol CO和2mol H2通入原体积为1L的恒压密闭容器(图3乙)中,在T2℃下达到平衡,此时反应的平衡常数为_________;若再向容器中通入l mol CH3OH(g),重新达到平衡后,CH3OH(g)在体系中的百分含量_________(填“变大”或“变小”或“不变”)。
(4)一定条件下也可用NaOH溶液与CO反应生成甲酸钠,进一步反应生成甲酸来消除CO污染。常温下将a mol的CO通入2 L bmol/L NaOH 溶液中,恰好完全反应生成甲酸钠和含少量甲酸的混合溶液(假设溶液体积不变),测得溶液中c(Na+)=c(HCOO-),则该混合溶液中甲酸的电离平衡常数 Ka=____________ (用含a和b的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com