
(10分)有A、B、C、D四种强电解质,它们在水中电离时可产生下列离子(每种物质只含一种阴离子且互不重复) 提示:CH3COONH4溶液为中性
|
阳离子 |
Na+、Ba2+、NH4+ |
|
阴离子 |
CH3COO-、Cl-、OH-、SO42- |
已知:①A、C溶液的pH均大于7,A、B的溶液中水的电离程度相同;
②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,A溶液和D溶液混合时无明显现象。
(1)A是______ ,B是_______ ,C是_______ ,D是________ 。
(2)用离子方程式表示A的水溶液显碱性的原因________________________________。
(3)25℃时,0.1mol·L-1 B溶液的pH=a,则B溶液中c(H+)-c(NH3·H2O)= _______(用含a的关系式表示)。
(4)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序为____________ _______。
(1)CH3COONa、NH4Cl、Ba(OH)2、Na2SO4(各1分) (2)CH3COO- + H2O  CH3COOH + OH-(2分)(3)1×10(a-14)(2分) (4)c(OH-)> c(Ba2+) = c(Cl-)> c(NH4+)> c(H+) (2分)
CH3COOH + OH-(2分)(3)1×10(a-14)(2分) (4)c(OH-)> c(Ba2+) = c(Cl-)> c(NH4+)> c(H+) (2分)
【解析】
试题分析::①A、C溶液的pH均大于7,应为醋酸盐和碱溶液,A、B的溶液中水的电离程度相同,则溶液水解程度相同;②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,A溶液和D溶液混合时无明显现象,则说明C为Ba(OH)2,D为Na2SO4,则B为NH4Cl
(1)根据题中信息推断出各物质分别为:A.CH3COONa,B.NH4Cl,C.Ba(OH)2,D.Na2SO4;
(2)醋酸钠水解呈碱性,离子方程式为CH3COO- + H2O  CH3COOH + OH-
CH3COOH + OH-
(3)在氯化铵中,存在电荷守恒:c(OH—)+ c(Cl—)=c(NH4+)+c(H+),存在原子守恒:c(Cl—)=c(NH4+)+ c(NH3·H2O);根据两个等式可以得出c(H+)-c(NH3·H2O)= c(OH—)=1×10(a-14)
(4)等体积、等物质的量浓度的NH4Cl和Ba(OH)2混合反应后溶液中溶质是BaCl2、Ba(OH)2、NH3?H2O,则c(OH-)>c(Ba2+)=c(Cl-)>c(NH4+)>c(H+),
考点:本题考查无机物的推断;电解质在水溶液中的电离;pH的简单计算;盐类水解的应用;
点评:题目较为综合,难度较大,正确推断各种物质为解答本题的关键。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
(本题共10分)有A、B、C、D、E、F六种元素。
①A、B、C是金属元素,位于同一周期,原子核外都有3个电子层,A的原子半径在所属周期中最大,且原子半径A>B>C。
②D、E是非金属元素,它们跟氢化合可生成气态氢化物HD和HE,在室温时,D的单质是液体,E的单质是固体。
③F的单质在常温下是气体,性质很稳定,是除氢外最轻的气体。
请回答:
(1)B位于周期表中第________周期______族,C的原子结构示意图是________。
(2)F单质的化学式是________。
(3)在上述六种元素中,最高价氧化物对应的水化物碱性最强的物质是_____,酸性最强的物质是________,气态氢化物最稳定的是________。
查看答案和解析>>
科目:高中化学 来源:2009—2010学年广州市七区联考高一化学下学期期末监测 题型:填空题
(本题共10分)有A、B、C、D、E、F六种元素。
①A、B、C是金属元素,位于同一周期,原子核外都有3个电子层,A的原子半径在所属周期中最大,且原子半径A>B>C。
②D、E是非金属元素,它们跟氢化合可生成气态氢化物HD和HE,在室温时,D的单质是液体,E的单质是固体。
③F的单质在常温下是气体,性质很稳定,是除氢外最轻的气体。
请回答:
(1)B位于周期表中第________周期______族,C的原子结构示意图是________。
(2)F单质的化学式是________。
(3)在上述六种元素中,最高价氧化物对应的水化物碱性最强的物质是_____,酸性最强的物质是________,气态氢化物最稳定的是________。
查看答案和解析>>
科目:高中化学 来源:2011-2012年湖北宜昌金东方学校高二上学期期末考试化学试卷(带解析) 题型:填空题
(10分)有A、B、C、D四种离子化合物,组成它们的离子分别为:
阳离子:Na+、Al3+、NH4+; 阴离子:OH-、NO3-、CO32-、HSO4-
为鉴别四种化合物,某学生分别取少量固体配成溶液,编号为A、B、C、D进行实验。实验过程和记录如下图所示(无关物质已略去)
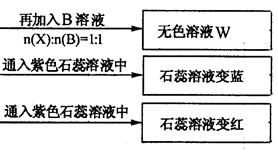
(1) Y、Z的化学式分别为:Y ;Z
(2)写出指定反应的离子方程式:
①加热条件下,C与过量B反应:
②D溶液显弱碱性的原因是(用离子方程式表示)
(3)等物质的量浓度的A、B、C、D溶液pH由大到小的顺序是(用化学式表示)
(4)若B、C的稀溶液混合后(不加热)溶液呈中性,则溶液中离子浓度从大到小的顺序是:
查看答案和解析>>
科目:高中化学 来源:2013届湖北宜昌金东方学校高二上学期期末考试化学试卷(解析版) 题型:填空题
(10分)有A、B、C、D四种离子化合物,组成它们的离子分别为:
阳离子:Na+、Al3+、NH4+; 阴离子:OH-、NO3-、CO32-、HSO4-
为鉴别四种化合物,某学生分别取少量固体配成溶液,编号为A、B、C、D进行实验。实验过程和记录如下图所示(无关物质已略去)
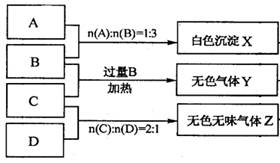
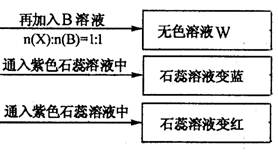
(1) Y、Z的化学式分别为:Y ;Z
(2)写出指定反应的离子方程式:
①加热条件下,C与过量B反应:
②D溶液显弱碱性的原因是(用离子方程式表示)
(3)等物质的量浓度的A、B、C、D溶液pH由大到小的顺序是(用化学式表示)
(4)若B、C的稀溶液混合后(不加热)溶液呈中性,则溶液中离子浓度从大到小的顺序是:
查看答案和解析>>
科目:高中化学 来源:2009-2010学年广州市七区联考高一化学下学期期末监测 题型:填空题
(本题共10分)有A、B、C、D、E、F六种元素。
①A、B、C是金属元素,位于同一周期,原子核外都有3个电子层,A的原子半径在所属周期中最大,且原子半径A>B>C。
②D、E是非金属元素,它们跟氢化合可生成气态氢化物HD和HE,在室温时,D的单质是液体,E的单质是固体。
③F的单质在常温下是气体,性质很稳定,是除氢外最轻的气体。
请回答:
(1)B位于周期表中第________周期______族,C的原子结构示意图是________。
(2)F单质的化学式是________。
(3)在上述六种元素中,最高价氧化物对应的水化物碱性最强的物质是_____,酸性最强的物质是________,气态氢化物最稳定的是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com