
【题目】己二酸主要用于生产尼龙66盐、合成树脂及增塑剂等。已二酸的合成路线如下:

制备己二酸的装置示意图如图所示(加热和夹持装置等略)。
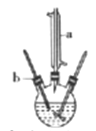
实验步骤:
I.己二酸的制备
连装好装置后,通过瓶口b慢慢滴加1.5g环已醇至适量KMnO4和NaOH的混合溶液中,然后塞上带有温度计的胶塞,再用沸水浴加热数分钟。
II.分离提纯
趁热过滤,收集滤液,用少量热水洗涤滤渣2次,合并滤液和洗涤液,边搅拌边滴加浓盐酸至溶液呈强酸性,小心加热蒸发浓缩至10mL左右,在冷水浴中冷却,析出已二酸粗品。
回答下列问题:
(1)写出仪器a的名称:______________。
(2)分离提纯过程中滴加的浓盐酸的作用是______________。
(3)将已二酸粗品提纯的方法是_______________。
A.过滤 B.萃取 C.重结晶 D.蒸馏
(4)步骤II中过滤时需要用到的玻璃仪器有玻璃棒____、_____。洗涤滤渣的目的是__________。
(5)若制得纯已二酸的质量为1.5g,则己二酸的产率为__________。
【答案】 直形冷凝管(或冷凝管) 将己二酸钠完全转化为己二酸 C 烧杯 漏斗 减少己二酸钠的损失,提高己二酸的产量 68.5%
【解析】(1)根据实验装置图及常见的仪器分析;
(2)根据己二酸的酸性弱于盐酸分析;
(3)根据已二酸常温下为固体,温度较低时会从溶液中析出分析;
(4)根据过滤操作分析;滤渣中含有己二酸钠;
(5)根据实际产量与理论产量的比值计算产率。
(1)由实验装置图可知,图中仪器a的名称是直形冷凝管(或冷凝管);
(2)浓盐酸是强酸,酸性强于己二酸,分离提纯过程中滴加的浓盐酸的作用是将己二酸钠完全转化为己二酸;
(3)因为己二酸常温下为固体,温度较低时会从溶液中析出,所以将已二酸粗品提纯的方法是重结晶,答案选C;
(4)步骤II中过滤时需要用到的玻璃仪器有玻璃棒、烧杯和漏斗;滤渣中含有己二酸钠,因此洗涤滤渣的目的是减少己二酸钠的损失,提高己二酸的产量;
(5)根据原子守恒可知生成己二酸的质量为![]() ,所以产率是1.5g/2.19g×100%=68.5%。
,所以产率是1.5g/2.19g×100%=68.5%。


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】一定能在下列溶液中大量共存的离子组是 ( )
A.K+、Na+、S2-、MnO4-B.Na+、NH4+、SO42-、Cl-
C.Fe3+、Mg2+、NO3-、SCN-D.NO3-、H+、Fe2+、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】500 多年前,一艘载着天然苏打晶体(Na2CO3·10H2O)的商船在航行中搁浅,船员们便在附近的沙滩上用几块苏打晶体支锅煮饭。之后他们惊奇地发现,在苏打与沙粒接触的地方出现了许多晶莹发亮的珠子。回答下列问题:
(1)沙滩上沙粒的主要成分为_______(填化学式)。
(2)上述晶莹发亮的珠子可能是______(填字母)。
A. 水晶颗粒 B.无水碳酸钠 C.晶体硅 D.玻璃珠
(3)生成该珠子时发生反应的化学方程式为_____________。
(4)氢氟酸常用作玻璃的蚀刻剂,原因是______________(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把下列物质分别加入盛水的锥形瓶,立即塞紧带U形管的塞子。已知U形管内预先装有少量水且液面相平(为便于观察,预先染成红色),加入下列哪些物质后,发生如如图所示变化( )

① NH4NO3晶体 ② 浓H2SO4 ③ NaOH粉末
④ NaCl晶体 ⑤ Na2O2固体 ⑥ 生石灰
A. ①②④⑤ B. ①②③
C. ③④⑤ D. ②③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G是几种烃分子的球棍模型(如图),据此回答下列问题:

(1)常温下含氢质量分数最高的气态烃是______(填字母)。
(2)写出E失去一个氢原子后所得烃基的结构筒式:______________。
(3)一卤代物种类最多的是_______(填字母)。
(4)写出实验室制取D的化学方程式:________________。
(5)写出F发生硝化反应的化学方程式:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于2 mol氨气,下列说法正确的是
A. 质量为17 g
B. 含有6.02×![]() 个NH3分子
个NH3分子
C. 标准状况下的体积为44.8 L
D. 溶于1 L水后,溶液中NH4+的浓度为2 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)北京市场销售的某种食用精制盐包装袋上有如下说明:

Ⅰ.碘酸钾与碘化钾在稀硫酸酸化条件下发生如下反应:KIO3+5KI+ 5H2SO4=3K2SO4+ 3I2+3H2O
甲乙两位同学分别用不同的方法配制所需的100mL 3.6molL﹣1的稀硫酸。
(1)若采用18molL﹣1的浓硫酸配制溶液,需要用量筒量取浓硫酸的体积为_______mL;
(2)甲学生:量取浓硫酸,在烧杯中稀释,冷却至室温后转移到100mL容量瓶中,洗涤,然后定容,塞好瓶塞,反复上下颠倒摇匀。配制过程中多次用到玻璃棒,其主要作用是______________________。
(3)若实验中进行下列操作使硫酸溶液的物质的量浓度偏高的是_____________。
①定容时观察液面俯视②未经冷却趁热将溶液注入容量瓶中
③摇匀后发现液面低于刻度线再加水④容量瓶中原有少量蒸馏水
(4)乙学生:用100mL量筒量取浓硫酸,并向其中小心地加入少量水,搅拌均匀,待冷却至室温后,再加水至100mL刻度线,搅拌均匀,你认为此法是否正确?若不正确,指出其中错误之处__________________。
Ⅱ.已知上述反应生成的I2可发生如下反应:I2+2S2O32—=2I-+S4O62—。某学生测定食用精制盐的碘含量,其步骤为:a.准确称取w g食盐,加适量蒸馏水使其完全溶解;b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;c.以淀粉溶液为指示剂,逐滴加入物质的量浓度为1.0×10-3mol/L 的Na2S2O3溶液20.0 mL,恰好反应完全。
(1)b中反应所产生的I2的物质的量是________ mol。
(2)根据以上实验和包装袋说明,所测精制盐的碘含量是_______________ mg/kg。(以含w的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在酸性溶液中,能大量共存的是离子组是 ( )
A.Mg2+、Fe2+、NO3-、SCN-B.Al3+、Fe2+、Cl-、SO42-
C.K+、Na+、Cl-、HCO3-D.Na+、Ba2+、NO3-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有机物A与NaOH的醇溶液混合加热得产物C和溶液D。C与乙烯混合在催化剂作用下可反应生成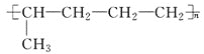 的高聚物。而在溶液D中先加入硝酸酸化,后加AgNO3溶液有白色沉淀生成,则A的结构简式可能为( )
的高聚物。而在溶液D中先加入硝酸酸化,后加AgNO3溶液有白色沉淀生成,则A的结构简式可能为( )
A. 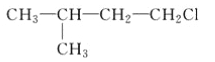 B.
B. 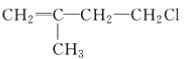 C. CH3CH2CH2ClD.
C. CH3CH2CH2ClD. 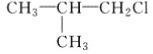
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com