
【题目】向mg镁和铝的混合物重加入适量的稀硫酸,恰好完全反应生成标准状况下的气体bL.向反应后的溶液中加入cmol/L氢氧化钾溶液VmL,使金属离子刚好沉淀完全,得到的沉淀质量为ng.再将得到的沉淀灼烧至质量不再改变为止,得到固体pg.则下列关系不正确的是( )
A.c= ![]()
B.p=m+ ![]()
C.n=m+17Vc
D.![]() m<p<
m<p< ![]() m
m
【答案】C
【解析】解:A.根据电荷守恒,氢氧化镁、氢氧化铝沉淀中含有n(OH﹣),等于金属提供的电子的物质的量,等于生成氢气的获得的电子的物质的量,故生成的氢气的物质的量等于参加反应的碱的物质的量的一半,故 ![]() ×2=cmol/L×V×10﹣3L,整理得c=
×2=cmol/L×V×10﹣3L,整理得c= ![]() ,故A正确; B.选项中p为生成的氧化物的质量,由Mg(OH)2
,故A正确; B.选项中p为生成的氧化物的质量,由Mg(OH)2 ![]() MgO+H2O,2Al(OH)3
MgO+H2O,2Al(OH)3 ![]() Al2O3+3H2O可知,氧化物的质量等于金属质量与氧原子的质量之和,由方程式可知氧原子的物质的量等于氢氧根离子物质的量的一半,故p=m+c×V×10﹣3×
Al2O3+3H2O可知,氧化物的质量等于金属质量与氧原子的质量之和,由方程式可知氧原子的物质的量等于氢氧根离子物质的量的一半,故p=m+c×V×10﹣3× ![]() ×16=m+
×16=m+ ![]() ,故B正确;
,故B正确;
C.沉淀为氢氧化镁、氢氧化铝,其质量等于金属的质量与含有的氢氧根离子的质量之和,故n=m+c×V×10﹣3×17=m+ ![]() ,故C错误;
,故C错误;
D.得到的氧化物为氧化镁,根据元素守恒,则质量为P= ![]() ×40=
×40= ![]() ,若mg全是铝,得到的氧化物为氧化铝,根据元素守恒,则质量为p=
,若mg全是铝,得到的氧化物为氧化铝,根据元素守恒,则质量为p= ![]() ×
× ![]() ×102=
×102= ![]() ,质量介于二者之间,故D正确;
,质量介于二者之间,故D正确;
故选C.
反应化学方程式为:Mg+H2SO4=MgSO4+H2↑;2Al+3H2SO4=Al2(SO4)3+3H2↑;MgSO4+2KOH=Mg(OH)2↓+K2SO4;Al2(SO4)3+6KOH=2Al(OH)3↓+3K2SO4;Mg(OH)2 ![]() MgO+H2O;2Al(OH)3
MgO+H2O;2Al(OH)3 ![]() Al2O3+3H2O;
Al2O3+3H2O;
A.根据n= ![]() 计算氢气的物质的量,根据电荷守恒,氢氧化镁、氢氧化铝沉淀中含有n(OH﹣)等于金属提供的电子的物质的量,等于生成氢气的获得的电子的物质的量,据此计算氢氧根离子的物质的量,再根据c=
计算氢气的物质的量,根据电荷守恒,氢氧化镁、氢氧化铝沉淀中含有n(OH﹣)等于金属提供的电子的物质的量,等于生成氢气的获得的电子的物质的量,据此计算氢氧根离子的物质的量,再根据c= ![]() 计算氢氧化钾的物质的量浓度;
计算氢氧化钾的物质的量浓度;
B.由Mg(OH)2 ![]() MgO+H2O,2Al(OH)3
MgO+H2O,2Al(OH)3 ![]() Al2O3+3H2O可知,沉淀灼烧生成氧化镁与氧化铝,二者质量等于金属质量与氧原子的质量之和,由方程式可知氧原子的物质的量等于氢氧根离子物质的量的一半,据此计算;
Al2O3+3H2O可知,沉淀灼烧生成氧化镁与氧化铝,二者质量等于金属质量与氧原子的质量之和,由方程式可知氧原子的物质的量等于氢氧根离子物质的量的一半,据此计算;
C.沉淀为氢氧化镁、氢氧化铝,其质量等于金属的质量与含有的氢氧根离子的质量之和,根据n=cVM计算氢氧根离子的质量;
D.按照极值方法计算,若mg全是镁,计算生成得到的氧化镁质量,若mg全是铝,计算得到的氧化铝的质量,实际固体的质量介于二者之间.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G均为芳香族化合物,有如下转化关系:![]()
(1)有机物C的分子式为C8H10O2 , 核磁共振氢谱显示3组峰,C不能与NaOH反应,写出C的结构简式 . 上述反应中属于取代反应的是(填数字序号).
(2)写出反应②、③的化学方程式:; .
(3)1mol D与足量的银氨溶液完全反应生成E,E是合成纤维涤纶的一种单体,另一种单体是C,写出合成涤纶的化学方程式 .
(4)1mol E、F(F的式量小于E)完全燃烧,消耗O2的量相等,且1 mol F能和1mol NaOH完全反应,写出F的结构简式 .
(5)G的分子式为C8H8O4 , 且知苯环上的一氯取代物只有两种,G不与NaHCO3反应,能与Na和NaOH反应,等质量的G消耗Na和NaOH的物质的量之比为2:3,则符合上述条件G的结构简式为(写出一种).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物分子中与“O﹣C﹣”相连的碳原子上的氢活性较大,可以与甲醛或卤代烃等发生反应.已知:
有机物J是重要的工业原料,其合成路线如下(部分产物和反应条件略):
(1)A中所含官能团的名称是 .
(2)A→B的反应类型是反应.
(3)G俗称缩苹果酸,与B以物质的量之比1:2反应,则G+B→H的化学方程式是 .
(4)J的同分异构体X属于芳香族化合物,1mol X与足量Na或NaOH反应时的物质的量之比分别是1:4和1:1,且苯环上只有一种一氯代物.符合上述条件的X有种,写出其中任意一种的结构简式: .
(5)已知E中只有一种官能团,且核磁共振氢谱显示其分子中有两种不同化学环境的氢.则下列说法正确的是(填序号);E的分子式是 . a.E与B互为同系物
b.E中含有的官能团是羟基
c.F在一定条件下也可转化为E
d.F中也有两种不同化学环境的氢
(6)J的结构简式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 国际上规定,0.012kg12C原子所含有的碳原子的物质的量为1摩
B. 胶体是带电的,溶液是呈电中性的
C. 在00C、1.01×105Pa下,1molCCl4的体积约为22.4L
D. 硫酸根离子的摩尔质量是96g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一包铁粉和铜粉混合均匀的粉末样品,为确定其组成,某同学将不同质量的该样品分别与40 mL 1 mol/L的FeCl3溶液反应,实验结果如下表所示(忽略反应前后溶液体积的微小变化)。
实验序号 | ① | ② | ③ | ④ |
m(粉末样品)/g | 0.90 | 1.80 | 3.60 | 7.20 |
m(反应后剩余固体)/g | 0 | 0.64 | 2.48 | 6.08 |
下列实验结论不正确的是
A. 实验②反应后溶液中含有Fe2+、Cu2+ B. 实验②③④反应后剩余固体全部是Cu
C. 实验④的滤液中c(Fe2+)=1.5 mol/L D. 原粉末样品中n(Fe)∶n(Cu)=1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作能促进水的电离,且使溶液呈酸性的是
A.向水中加人少量氯化铁固体B.向水中加入少量氯化铵固体
C.向水中加入少量NaHCO3固体D.向水中通入少量氯化氢气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】x、y、z三种物质的分子组成分别符合烷烃、烯烃、炔烃的通式,若在一定条件下VL的x、y、z的混合气体可与V L的H2发生加成反应,则混合气体中x、y、z的体积比可能是( )
A.1:1:1
B.1:2:3
C.1:4:2
D.3:2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,在某密闭容器内某一反应中M,N的物质的量随反应时间变化的曲线如图所示.下列叙述中,正确的是( ) 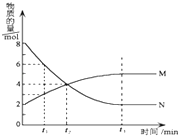
A.该反应的化学方程式为M═2N
B.若t1=1,则反应开始至t1时间段M 的反应速率为1mol﹒L﹣1﹒min﹣1
C.t2时正逆反应速率相等,反应达到平衡状态
D.t3时正反应速率等于逆反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4A(s)+3B(g)2C(g)+D(g),经2min B的浓度减少0.6molL﹣1 . 对此反应速率的正确表示是( )
A.用A表示的反应速率是0.8 molL﹣1s﹣1
B.分别用B,C,D表示反应的速率,其比值是3:2:1
C.在2 min末时的反应速率,用反应物B来表示是0.3 molL﹣1min﹣1
D.在这2 min内用B和C表示的反应速率的值都是相同的
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com