
【题目】X、Y、Z、Q、R是五种短周期元素,原子序数依次增大,X原子是所有原子中半径最小的,Y元素最高正价与最低负价之和为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素,请回答:
(1)R离子电子排布式为:_____________________。
(2)X与Q形成的化合物属于__________化合物(填“离子”或“共价”)
(3)由以上两种元素组成的化合物中,常温下呈液态的化合物A,原子比例为2:1,其结构式为__________,其熔点,沸点较高时因为分子间存在__________;呈淡黄色固体的化合物B,其电子式:__________。
(4)如果由三种元素组成化合物中,C为两性不溶物,D为强碱,则C与D反应的化学方程式为_____________________________________________。
【答案】1s22s22p6 离子 H-O-H 氢键 ![]() Al(OH)3+NaOH=NaAlO2+2H2O
Al(OH)3+NaOH=NaAlO2+2H2O
【解析】
X、Y、Z、Q、R是五种短周期元素,原子序数依次增大.X原子半径是所有元素中最小的,则X为H元素;Z、R分别是地壳中含量最高的非金属元素和金属元素,则Z为O元素、R为Al元素;Q与X同主族,即X、Q处于ⅠA族,Q原子序数介于O、Al之间,故Q为Na;Y元素最高正价与最低负价之和为0,Y处于ⅣA族,原子序数小于氧,故Y为C元素,据此解答。
(1)由上面分析可知,R为Al元素,原子序数为13,核外电子数也为13,失去最外层3个电子,Al3+核外10个电子,则Al3+的电子排布式为1s22s22p6;答案为1s22s22p6。
(2)X为H元素,Q为Na元素,二者形成NaH,电子式为![]() ,由离子键形成,属于离子化合物;答案为离子。
,由离子键形成,属于离子化合物;答案为离子。
(3)由H、C、O、Na、Al中的两种元素组成的化合物中,常温下呈液态的化合物A,原子比例为2:1,A为H2O,氧原子与两个氢原子之间各形成一对共用电子对,电子式为![]() ,结构式为H-O-H,其熔点、沸点较高是因为氧元素电负性较强,分子间存在氢键;呈淡黄色固体的化合物B为过氧化钠,钠离子与过氧根形成离子键,过氧根中两个氧原子形成一对共用电子对,其电子式为
,结构式为H-O-H,其熔点、沸点较高是因为氧元素电负性较强,分子间存在氢键;呈淡黄色固体的化合物B为过氧化钠,钠离子与过氧根形成离子键,过氧根中两个氧原子形成一对共用电子对,其电子式为![]() ;答案为:H-O-H,氢键,
;答案为:H-O-H,氢键,![]() 。
。
(4)如果由三种元素组成化合物中,C为两性不溶物,则C为Al(OH)3,D为强碱,则D为NaOH,C与D反应的化学方程式为:Al(OH)3+NaOH=NaAlO2+2H2O;答案为Al(OH)3+NaOH=NaAlO2+2H2O。


科目:高中化学 来源: 题型:
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验。
实验一 制取氯酸钾和氯水
利用下图所示的实验装置进行实验。

(1)制取实验结束后,取出B中试管冷却结晶,过滤,洗涤。该实验操作过程需要的玻璃仪器有________。
(2)若对调B和C装置的位置,________(填“能”或“不能”)提高B中氯酸钾的产率。
实验二 氯酸钾与碘化钾反应的研究
(3)在不同条件下KClO3可将KI氧化为I2或KIO3。该小组设计了系列实验研究反应条件对反应产物的影响,其中系列a实验的记录表如下(实验在室温下进行):
试管编号 | 1 | 2 | 3 | 4 |
0.20 mol·L-1 KI/mL | 1.0 | 1.0 | 1.0 | 1.0 |
KClO3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
6.0 mol·L-1H2SO4/mL | 0 | 3.0 | 6.0 | 9.0 |
蒸馏水/mL | 9.0 | 6.0 | 3.0 | 0 |
实验现象 |
①系列a实验的实验目的是________________。
②设计1号试管实验的作用是________________。
③若2号试管实验现象为“黄色溶液”,取少量该溶液加入淀粉溶液显蓝色;假设氧化产物唯一,还原产物为KCl,则此反应的离子方程式为___________________________。
实验三 测定饱和氯水中氯元素的总量
(4)该小组设计的实验方案为使用下图装置,加热15.0 mL饱和氯水试样,测定产生气体的体积。此方案不可行的主要原因是__________________________。(不考虑实验装置及操作失误导致不可行的原因)

(5)根据下列资料,为该小组设计一个可行的实验方案(不必描述操作过程的细节):______________________________________________________________________。
资料:ⅰ.次氯酸会破坏酸碱指示剂;
ⅱ.次氯酸或氯气可被SO2、H2O2和FeCl2等物质还原成Cl-。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为某机物与对应试剂的反应现象或是否反应,则这种有机物可能是( )
试剂 | 钠 | 溴水 | NaHCO3溶液 |
现象 | 放出气体 | 褪色 | 放出气体 |
A.CH2=CH-CH2-OH
B.![]()
C.CH2=CH-COOH
D.CH3COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙三酸是一种有机酸,用![]() 表示。
表示。![]() 时,向
时,向![]() 的
的![]() 溶液中逐滴加入NaOH溶液,滴加过程中各种含A微粒物质的物质的量分数
溶液中逐滴加入NaOH溶液,滴加过程中各种含A微粒物质的物质的量分数![]() 随溶液pH的变化曲线如图所示。下列相关说法正确的是
随溶液pH的变化曲线如图所示。下列相关说法正确的是
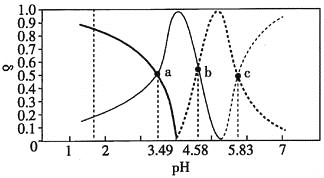
A.a点溶液中:![]()
B.![]() 时,
时,![]() 的第二步电离平衡常数的数量级为
的第二步电离平衡常数的数量级为![]()
C.b点溶液中:![]()
D.当该溶液中![]() 时,溶液中水电离出的
时,溶液中水电离出的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,向50.00mL未知浓度的氨水中逐滴加入0.5mol·L-1的HC1溶液。滴定过程中,溶液的pOH[pOH=-lgc(OH-)]与滴入HCl溶液体积的关系如图所示,则下列说法中正确的是
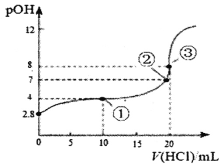
A. 图中②点所示溶液的导电能力弱于①点
B. ③点处水电离出的c(H+)=1×10-8mol·L-1
C. 图中点①所示溶液中,c(C1-)>c(NH4+)>c(OH-)>c(H+)
D. 25℃时氨水的Kb约为5×10-5.6mo1·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)是常用的还原剂。在一定体积的某维生素C(化学式C6H8O6)溶液中加入a mol·L-1I2溶液V1 mL,使维生素C完全氧化,充分反应后,用Na2S2O3溶液滴定剩余的I2,消耗b mol·L-1 Na2S2O3溶液V2 mL。
已知发生的反应为:C6H8O6+I2=C6H6O6+2H++2I- , 2S2O32-+I2=S4O62-+2I-
该溶液中维生素C的物质的量是多少mol?(写出简要的计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物P的结构简式为![]() 。下列关于该有机物的说法不正确的是( )
。下列关于该有机物的说法不正确的是( )
A.向有机物P中直接加入银氨溶液,并水浴加热可以发生银镜反应
B.有机物P中以使溴的四氯化碳溶液退色
C.有机物P可以发生中成、水解、酯化、中和、氧化取代反应
D.1mol有机物P最多可以和2mol![]() 反应
反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某透明澄清的溶液中可能含有NO3- 、Cl- 、SO42-、CO32-、NH4+、Fe3+、Al3+和K+中的几种,且所含阴离子的物质的量相等。为确定该溶液的成分,某学习小组做了如下实验:①取该溶液100mL,加入过量NaOH溶液,加热得到0.02mol气体,同时产生红褐色沉淀; ②将沉淀过滤、洗涤、灼烧,得到1.6 g固体; ③向上述滤液中加入足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀。下列说法正确的是
A. 不能确定原溶液中是否含有Al3+和K+
B. 原溶液中含有的离子只有:Cl- 、SO42-、NH4+、Fe3+
C. 原溶液中c(NO3-)=0.2 mol·L-1 c(Fe3+)=0.2 mol·L-1
D. 在原溶液中加入足量的铁粉所得溶液中阳离子所带正电荷数减少
【答案】C
【解析】①取该溶液100mL,加入过量NaOH溶液,加热得到0.02mol气体,说明溶液中含有0.02mol NH4+,同时产生红褐色沉淀为氢氧化铁,说明溶液中含有Fe3+,CO32-与Fe3+会发生双水解而不能大量共存,故溶液中一定不含CO32-;②将沉淀过滤、洗涤、灼烧,得到1.6 g固体为氧化铁,则n[Fe(OH)3]=2n(Fe2O3)=2×![]() =0.02mol; ③向上述滤液中加入足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀,则沉淀为硫酸钡,n(SO42-)=n(BaSO4)=
=0.02mol; ③向上述滤液中加入足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀,则沉淀为硫酸钡,n(SO42-)=n(BaSO4)= ![]() =0.02mol。n(+)=n(NH4+)+3n(Fe3+)=0.02mol+3×0.02mol=0.08mol,n(-)=2 n(SO42-)=2×0.02mol=0.04mol<0.08mol,故溶液中还有其他阴离子,且所含阴离子的物质的量相等,故n(-)=2 n(SO42-)+n(NO3-)+n(Cl-)=2×0.02mol+0.02mol+0.02mol=0.08mol,因此溶液中一定含有NO3- 、Cl-,一定不含Al3+和K+。故A.原溶液中一定不含Al3+和K+,选项A错误;B. 原溶液中含有的离子只有:NO3- 、Cl- 、SO42-、NH4+、Fe3+,选项B错误;C. 原溶液中c(NO3-)=0.2 mol·L-1,c(Fe3+)=0.2 mol·L-1,选项C正确;D. 在原溶液中加入足量的铁粉,发生反应:2Fe3++ Fe = 3Fe2+所得溶液中阳离子所带正电荷数基本不变,选项D错误。答案选C。
=0.02mol。n(+)=n(NH4+)+3n(Fe3+)=0.02mol+3×0.02mol=0.08mol,n(-)=2 n(SO42-)=2×0.02mol=0.04mol<0.08mol,故溶液中还有其他阴离子,且所含阴离子的物质的量相等,故n(-)=2 n(SO42-)+n(NO3-)+n(Cl-)=2×0.02mol+0.02mol+0.02mol=0.08mol,因此溶液中一定含有NO3- 、Cl-,一定不含Al3+和K+。故A.原溶液中一定不含Al3+和K+,选项A错误;B. 原溶液中含有的离子只有:NO3- 、Cl- 、SO42-、NH4+、Fe3+,选项B错误;C. 原溶液中c(NO3-)=0.2 mol·L-1,c(Fe3+)=0.2 mol·L-1,选项C正确;D. 在原溶液中加入足量的铁粉,发生反应:2Fe3++ Fe = 3Fe2+所得溶液中阳离子所带正电荷数基本不变,选项D错误。答案选C。
【题型】单选题
【结束】
8
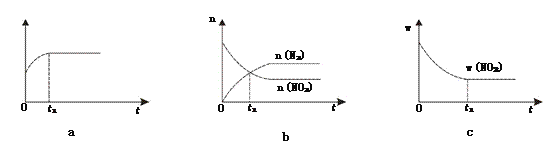
【题目】根据要求回答下列问题:
(1)已知恒温、恒容条件下发生反应:2NO2(g)+2C(s) ![]() N2(g)+2CO2(g)。
N2(g)+2CO2(g)。
①下列图像说明该反应进行到t1时刻未达平衡状态的是________(填选项字母)。
②1 molNO2和足量C发生反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示。
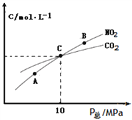
图中A、B、C三点NO2的转化率最高的是_____,该反应的平衡常数Kp=_______(Kp是用平衡分压代替平衡浓度的常数,分压=总压×物质的量分数)。
(2)已知:弱电解质的电离平衡常数为
物质 | H2CO | H2S | HNO2 |
电离平衡常数 (25℃) | Ka1=4.2×10-7 Ka2=5.61×10-11 | Ka1=1.3×10-7 Ka2=7.1×10-15 | Ka=5.1×10-4 |
①含有1L 2mol·L-1碳酸钠的溶液中加入1L 1mol·L-1的HNO2后,则溶液中CO32-、HCO3-和NO2-的离子浓度由大到小是_______。
②25℃时,在0.10 mol·L-1H2S溶液中,通人HCl气体或加入NaOH固体,溶液pH与c(S2-)关系如图所示(忽略溶液体积的变化、H2S的挥发)。pH=13时,溶液中的c(H2S)+c(HS-)=____mol·L-1;
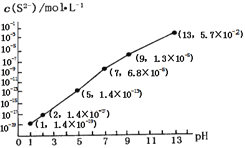
③向10.00mL0.10 mol·L-1的氢硫酸中滴加10.00mL0.1 mol·L-1NaOH溶液,溶液呈_____性,其定量依据是______________________ .
(3)已知:①CaSO4(s)+CO(g)![]() CaO(s)+SO2(g)+CO2(g)△H = +210.5kJmol-1
CaO(s)+SO2(g)+CO2(g)△H = +210.5kJmol-1
②CaSO4(s)+4CO(g)![]() CaS(s)+4CO2(g) △H= -189.2kJmol-1
CaS(s)+4CO2(g) △H= -189.2kJmol-1
则:CaO(s)+3CO(g)+SO2(g) ![]() CaS(s)+3CO2(g) △H=_______kJmol-1.
CaS(s)+3CO2(g) △H=_______kJmol-1.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com