
【题目】下列图示与对应的叙述相符的是
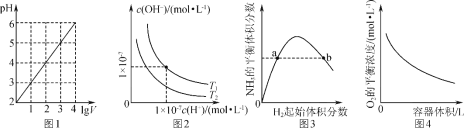
A. 图1表示1 L pH=2的CH3COOH溶液加水稀释至V L,pH随lg V的变化
B. 图2表示不同温度下水溶液中H+和OH-浓度的变化的曲线,图中温度T2<T1
C. 图3表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率等于b点
D. 图4表示同一温度下,相同物质的量BaO2在不同容积的容器中进行反应:2BaO2(s)![]() 2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
【答案】B
【解析】
A、醋酸是弱酸溶液中存在电离平衡,加水稀释促进电离,加水稀释10n倍,促进醋酸的电离,溶液的pH变化小于n个单位;
B、图象分析可知,T2温度下,氢离子浓度和氢氧根离子浓度乘积小于T1温度下氢离子浓度和氢氧根离子浓度乘积,水的电离是吸热过程,温度越高水电离程度越大,氢离子和氢氧根离子浓度乘积越大;
C、图象分析可知,随氢气体积分数增大,平衡正向进行氨气平衡体积分数增大,但随氢气量的增大超过平衡移动量的增大,氨气的体积分数会减小,但增大氢气的浓度,氮气转化率增大;
D、同一温度下,在不同容积的容器中进行反应2BaO2(s)![]() 2BaO(s)+O2(g),体积越大压强越小,则平衡正向进行,氧气浓度增大,最终与原浓度,相同温度下平衡常数不变,此反应的平衡常数K=c(O2)。
2BaO(s)+O2(g),体积越大压强越小,则平衡正向进行,氧气浓度增大,最终与原浓度,相同温度下平衡常数不变,此反应的平衡常数K=c(O2)。
A.加水稀释10n倍,促进醋酸的电离,溶液的pH变化小于n个单位,所以1 LpH=2的CH3COOH溶液加水稀释至V L,pH变化小于lgV,故A错误;
B.升温促进水电离,Kw增大,水电离的氢离子浓度增大,所以氢离子浓度大的温度高,即温度T2<T1,故B正确;
C.增大氢气的浓度,提高氮气的转化率,所以随H2起始体积分数增大,N2的转化率增大,即a点N2的转化率小于b点,故C错误;
D.增大容器的体积,氧气的浓度减小,平衡向正方向移动,氧气的物质的量增大,氧气的浓度先增大,当达到平衡状态时浓度增大,然后随着体积的增大浓度减小,温度不变,平衡常数不变,K=c(O2),最终氧气平衡浓度不变,则图象不符,故D错误。
故选:B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】已知NA为阿伏加德罗常数的值,下列说法正确的是
A. 3gCO2中含有的质子数为1.5NA
B. 1L0.1mol·L-1 Na2SiO3溶液中含有的SiO32-数目为0.1NA
C. 0.1molH2O2分解产生O2时,转移的电子数为0.2NA
D. 2.8g聚乙烯中含有的碳碳双键数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石墨电极电解100 mL H2SO4与CuSO4的混合溶液,通电一段时间后,两极均收集到2.24 L气体(标准状况),则原混合溶液中Cu2+的物质的量浓度为( )
A.3 mol·L-1B.2 mol·L-1C.4 mol·L-1D.1 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:2X(g)+Y(s)![]() Z(g)+W(g),若其化学平衡常数K和温度t的关系如下表
Z(g)+W(g),若其化学平衡常数K和温度t的关系如下表

下列叙述不正确的是( )
A.上述反应的正反应是吸热反应
B.该反应的化学平衡常数表达式为K=![]()
C.若在1L的密闭容器中通入X和Y各1mol,5min后温度升高到800℃,此时测得X为0.33mol,该反应达到平衡状态
D.混合气体的密度保持不变可作为该反应达到平衡的标志之一
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次硫酸钠甲醛(xNaHSO2yHCHOzH2O)俗称吊白块,在印染、医药以及原子能工业中有广泛应用。它的组成可通过下列实验测定:①准确称取1.5400g样品,完全溶于水配成100mL溶液。②取25.00mL所配溶液经AHMT分光光度法测得甲醛物质的量浓度为0.10mol×L-1。③另取25.00mL所配溶液,加入过量碘完全反应后,加入BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重得到白色固体0.5825g。次硫酸氢钠和碘反应的方程式如下:xNaHSO2yHCHOzH2O+I2→NaHSO4+HI+HCHO+H2O(未配平)
(1)生成0.5825g白色固体时,需要消耗碘的质量为_____。
(2)若向吊白块溶液中加入氢氧化钠,甲醛会发生自身氧化还原反应,生成两种含氧有机物,写出该反应的离子方程式_____。
(3)通过计算确定次硫酸氢钠甲醛的组成______(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述不正确的是
A.冰醋酸中逐滴加水,则溶液的导电性和醋酸的电离程度均先增大后减小
B.若根据反应“![]() ”设计成燃料电池,既可发电同时还可用于制备盐酸
”设计成燃料电池,既可发电同时还可用于制备盐酸
C.可逆反应的正、逆反应平衡常数数值互为倒数
D.电镀铜时,纯铜做阳极,电镀液为![]() 溶液
溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:![]()
![]()
![]() 某温度下,在4L密闭容器中加入纳米级
某温度下,在4L密闭容器中加入纳米级![]() 并通入
并通入![]()
![]() ,记录不同时间产生
,记录不同时间产生![]() 的物质的量如表:
的物质的量如表:
时间 | 20 | 40 | 60 | 80 |
|
|
|
|
|
下列说法正确的是
A.前20min的反应速率![]()
B.达平衡时,至少需要从外界吸收的能量为![]()
C.增大![]() ,可以提高水的分解率
,可以提高水的分解率
D.使用纳米级![]() 颗粒是为了提高催化效果
颗粒是为了提高催化效果
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷及其化合物在化工生产中有着广泛的应用,请对下列问题作答。
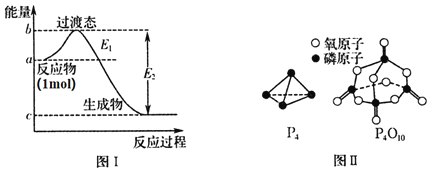
![]() 有多种单质,其中一种叫白磷,分子式为
有多种单质,其中一种叫白磷,分子式为![]() ,结构如图Ⅱ所示,
,结构如图Ⅱ所示,![]() 分子的活泼性比
分子的活泼性比![]() 分子______
分子______![]() 填强或弱
填强或弱![]() 。
。
![]() 白磷燃烧的能量变化图和产物结构如图Ⅰ、图Ⅱ所示,假设
白磷燃烧的能量变化图和产物结构如图Ⅰ、图Ⅱ所示,假设![]() 、
、![]() 、
、![]() 的键能分别为x、y、z,x、y、z、a、b、c均为正值,利用图中信息求出
的键能分别为x、y、z,x、y、z、a、b、c均为正值,利用图中信息求出![]() 的键能的表达式为______
的键能的表达式为______
![]() 已知含氧酸分子中只有羟基中的氢原子才能发生电离。
已知含氧酸分子中只有羟基中的氢原子才能发生电离。![]() 具有较强还原性而且该酸无酸式盐,分子中只含一个羟基,写出其电离方程式______
具有较强还原性而且该酸无酸式盐,分子中只含一个羟基,写出其电离方程式______
![]() 可用于化学镀镍。配平并完成下列化学方程式:
可用于化学镀镍。配平并完成下列化学方程式:
______![]() ______
______![]() ______
______![]() ______
______![]() ______
______![]() ______
______
![]() 磷酸是一种三元中强酸,已知
磷酸是一种三元中强酸,已知![]() ,
,![]() ,
,![]() ,
,![]() 的水溶液显______性,解释原因______。
的水溶液显______性,解释原因______。
![]() 是重要的化工原料,某温度下,反应
是重要的化工原料,某温度下,反应![]() 的化学平衡常数
的化学平衡常数![]() ,在1L的密闭容器中加入
,在1L的密闭容器中加入![]() ,平衡后
,平衡后![]() 的浓度是______。
的浓度是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置。下列叙述不正确的是
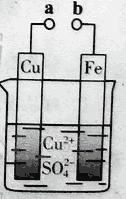
A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铜片上发生的反应为:Cu2++2e-= Cu
C. 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色
D. a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com