
【题目】下列反应曾用于检测司机是否酒后驾驶: 2Cr2O+3CH3CH2OH+16H++13H2O![]() 4[Cr(H2O)6]3++3CH3COOH
4[Cr(H2O)6]3++3CH3COOH
(1)Cr3+基态核外电子排布式为_______;配合物[Cr(H2O)6]3+中,与Cr3+形成配位键的原子是________(填元素符号)。
(2)CH3COOH中C原子轨道杂化类型为________;1 mol CH3COOH分子含有σ键的数目为________。
(3)与H2O互为等电子体的一种阴离子为________(填化学式);H2O与CH3CH2OH可以任意比例互溶,除因为它们都是极性分子外,还因为________。
【答案】1s22s22p63s23p63d3或[Ar]3d3 O sp3和sp2 7NA(或7×6.02×1023) NH2- H2O与CH3CH2OH之间可以形成氢键
【解析】
(1)Cr原子核外电子数为24,Cr3+核外电子排布式为1s22s22p63s23p63d3或[Ar]3d3,氯离子处于外界,与Cr3+形成配位键的配体分子是H2O分子,与Cr3+形成配位键的原子是O;
故答案为:1s22s22p63s23p63d3或[Ar]3d3;O;
(2)CH3COOH中-COO-中C原子形成3个σ键,另一个碳原子形成4个σ键,均没有孤对电子,杂化轨道数目分别为3、4,分别采取sp2、sp3杂化;1 mol CH3COOH分子含有σ键的数目为7NA(或7×6.02×1023);
故答案为:sp2、sp3杂化;7NA(或7×6.02×1023);
(3)原子数目相等、价电子总数也相等的微粒互为等电子体,与H2O互为等电子体的一种阴离子为NH2-(填化学式);H2O与CH3CH2OH可以任意比例互溶,除因为它们都是极性分子外,还因为H2O与CH3CH2OH之间可以形成氢键。
故答案为:NH2- ;H2O与CH3CH2OH之间可以形成氢键。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】镓(Ga)、锗(Ge)、硅(Si)、硒(Se)的单质及某些化合物如砷化镓、磷化镓等都是常用的半导体材料,应用于航空航天测控、光纤通讯等领域。回答下列问题:
(1)硒常用作光敏材料,基态硒原子的核外电子排布式为[Ar]_______;与硒同周期的p区元素中第一电离能大于硒的元素有_____种;SeO3的空间构型是_______。
(2)根据元素周期律,原子半径Ga ___As,第一电离能Ga _____As。(填“大于”或“小于”)
(3)水晶的主要成分是二氧化硅,在水晶中硅原子的配位数是______,硅与氢结合能形成一系列的二元化合物SiH4、Si2H6等,与氯、溴结合能形成SiCl4 、SiBr4,上述四种物质的沸点由高到低的顺序为__________,丁硅烯(Si4H8)中σ键与π键个数之比为___。
(4)GaN、GaP、GaAs都是很好的半导体材料,晶体类型与晶体硅类似,熔点如下表所示,分析其变化原因___。
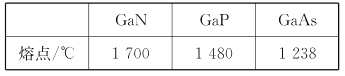
(5)GaN晶体结构如图所示。已知六棱柱底边边长为a cm,阿伏加德罗常数的值为NA。
①晶体中Ga原子采用六方最密堆积方式,每个Ga原子周围距离最近的Ga原子数目为_____。
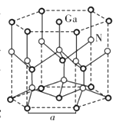
②从GaN晶体中“分割”出的平行六面体如图所示。若该平行六面体的体积为![]() cm3,GaN晶体的密度为____g/cm3(用a、NA表示)。
cm3,GaN晶体的密度为____g/cm3(用a、NA表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】判断正误,正确的画“√”,错误的画“×”
(1)2 g D![]() O中含有的质子数、中子数均为NA_______
O中含有的质子数、中子数均为NA_______
(2)过氧化钠与水反应时,生成0.1 mol氧气转移的电子数为0.2NA_______
(3)1.0 mol CH4与Cl2在光照下反应生成的CH3Cl分子数为1.0NA_______
(4)标准状况下,5.6 L NO和5.6 L O2组成的混合气体中所含原子数为NA_______
(5)0.1 mol钠和O2在一定条件下反应完全生成Na2O和Na2O2混合物时,失去电子数为0.1NA _______
(6)14 g乙烯和丙烯混合气体中的氢原子数为2NA_______
(7)在1L 0.1mol·L﹣1碳酸钠溶液中,阴离子总数大于0.1NA _______
(8)高温下,16.8 g Fe与足量水蒸气完全反应失去电子数为0.8 NA _______
(9)标准状况下,氢氧燃料电池正极消耗22.4 L气体时,电路中通过的电子数目为4NA_______
(10)常温常压下 ,1 L液态水中含有的H+数目为10-7NA_______
(11)一定条件下Fe粉与足量的浓硫酸反应,转移电子数为3 NA _______
(12)标准状况下,2.24 L CCl4含有的共价键数为0.4NA_______
(13)标况下,22.4L己烷的分子个数为NA_______
(14)含1 mol H2SO4的浓硫酸与足量Zn反应转移的电子总数为2NA_______
(15)在1L 0.1mol·L﹣1氯化铵溶液中,NH4+ 和NH3·H2O的个数之和为NA _______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在 3个体积均为 20L的密闭真空容器中发生如下反应(假设容器体积不变,固体试样体积忽略不计):NH2COONH4(s)![]() 2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据如表所示:
2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据如表所示:
容器 | 温度/℃ | 起始物质的量(n/mol) | 平衡物质的量(n/mol) | ||
n(NH2COONH4) | n(NH3) | n(CO2) | n(CO2) | ||
I | 15 | 1.00 | 0 | 0 | 0.016 |
II | 15 | 2.00 | 0 | 0 | a |
III | 35 | 0 | 4.00 | 2.00 | b |
下列说法不正确的是
A.当反应进行到30min时测得容器Ⅰ中混合气体的物质的量为 0.036mol,则30min 内该反应的平均速率 v(NH3)=4×10-5mol·L-1·min-1
B.当密闭容器中的二氧化碳的体积分数不变时,不能说明该反应到达了平衡
C.若该反应的正反应为吸热反应,则 b一定大于0.032
D.达到平衡时反应物的转化率:α(Ⅰ)> α (Ⅱ)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A经李比希法测得其中含C 72.0%、H 6.67%,其余为氧;质谱法分析得知A的相对分子质量为150。现代仪器分析有机化合物的分子结构有以下两种方法。
方法一:核磁共振仪测出A的核磁共振氢谱有5个峰,其面积之比为1∶2∶2∶2∶3。
方法二:利用红外光谱仪可初步检测有机化合物中的某些基团,现测得A分子的红外光谱如图:
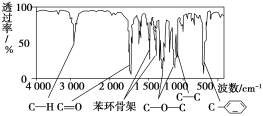
已知:A分子中只含一个苯环,且苯环上只有一个取代基。试回答下列问题。
(1)A的分子式为________。
(2)A的结构简式为_______________________________________________(写一种即可)。
(3)A的芳香化合物类同分异构体有多种,其中分子中不含甲基的芳香酸为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种形状像布袋结构的烯烃分子,其形状和结构如图所示,有关说法不正确的是( )

A. 该烯烃的分子式为C5H4
B. 该分子所有碳原子在同一平面
C. 1 mol该有机物最多可与2 mol Br2发生加成反应
D. 与其互为同分异构体且只含三键的链烃不止—种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,属于取代反应的是
①CH3CH=CH2+Br2![]() CH3CHBrCH2Br
CH3CHBrCH2Br
②CH3CH2OH![]() CH2=CH2+H2O
CH2=CH2+H2O
③CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
④C6H6+HNO3![]() C6H5NO2+H2O
C6H5NO2+H2O
A. ①②B. ③④C. ①③D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式氯化铜[CuaClb(OH)c·xH2O]是一种杀虫剂,它可以通过以下步骤制备。
步骤1:将铜粉加入稀盐酸中,并持续通空气反应生成 CuCl2。已知 Fe3+对该反应有催化作用,其催化原理如图所示。
步骤 2:在制得的 CuCl2 溶液中,加入石灰乳充分反应后即可制备碱式氯化铜。
下列有关说法正确的是
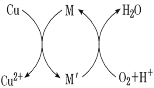
A.a、b、c之间的关系式为:a=b+c
B.图中 M、Mˊ分别为 Fe2+、Fe3+
C.步骤 1 充分反应后,加入少量 CuO 是为了除Fe3+
D.若制备 1 mol CuCl2,理论上消耗 11.2 L O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生命过程与化学平衡移动密切相关。血红蛋白(Hb)与O2结合成氧合血红蛋白(Hb(O2))的过程可表示为:Hb+O2(g)![]() Hb(O2)。下列说法正确的是
Hb(O2)。下列说法正确的是
A.体温升高,O2与Hb结合更快,反应的平衡常数不变
B.吸入新鲜空气,平衡逆向移动
C.CO达到一定浓度易使人中毒,是因为结合Hb使Hb(O2)分解速率增大
D.高压氧舱治疗CO中毒的原理是使平衡Hb(CO)+O2(g)![]() Hb(O2)+CO(g)右移
Hb(O2)+CO(g)右移
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com