
【题目】生命过程与化学平衡移动密切相关。血红蛋白(Hb)与O2结合成氧合血红蛋白(Hb(O2))的过程可表示为:Hb+O2(g)![]() Hb(O2)。下列说法正确的是
Hb(O2)。下列说法正确的是
A.体温升高,O2与Hb结合更快,反应的平衡常数不变
B.吸入新鲜空气,平衡逆向移动
C.CO达到一定浓度易使人中毒,是因为结合Hb使Hb(O2)分解速率增大
D.高压氧舱治疗CO中毒的原理是使平衡Hb(CO)+O2(g)![]() Hb(O2)+CO(g)右移
Hb(O2)+CO(g)右移
科目:高中化学 来源: 题型:
【题目】下列反应曾用于检测司机是否酒后驾驶: 2Cr2O+3CH3CH2OH+16H++13H2O![]() 4[Cr(H2O)6]3++3CH3COOH
4[Cr(H2O)6]3++3CH3COOH
(1)Cr3+基态核外电子排布式为_______;配合物[Cr(H2O)6]3+中,与Cr3+形成配位键的原子是________(填元素符号)。
(2)CH3COOH中C原子轨道杂化类型为________;1 mol CH3COOH分子含有σ键的数目为________。
(3)与H2O互为等电子体的一种阴离子为________(填化学式);H2O与CH3CH2OH可以任意比例互溶,除因为它们都是极性分子外,还因为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Z由如下反应得到:![]() ,Z的结构简式不可能是( )
,Z的结构简式不可能是( )
A.CH3CH2CHBrCH2BrB.CH3CH(CH2Br)2
C.CH3CHBrCHBrCH3D.CH2BrCBr(CH3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组设计如图实验,欲使甲中试管先出现浑浊,下列操作一定达不到目的的是

A.向甲烧杯中加入适量CaOB.向甲中试管内滴加适量浓硫酸
C.向乙烧杯中加入适量冰块D.增大甲装置所在环境的压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质问转化均能实现的是
A.SiO2(s)![]() H2SiO3(S)
H2SiO3(S)![]() Na2SiO3(aq)
Na2SiO3(aq)
B.Cu2S(s)![]() Cu(s)
Cu(s)![]() CuCl2(s)
CuCl2(s)
C.Fe(s)![]() Fe2O3(s)
Fe2O3(s) ![]() Fe2(SO4)3
Fe2(SO4)3
D.NaCl(aq) ![]() Na2CO3(s)
Na2CO3(s) ![]() NaOH(aq)
NaOH(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在1L的烧瓶中充入一定量N2O4气体。
(1)体系中气体颜色由浅变深,写出对应的化学方程式____________________。
(2)保持温度和容积不变,向达到平衡的容器中再充入一定量N2O4气体,平衡________移动(填“正向”、“逆向”或“不”),N2O4的转化率___________(填“增大”、“减小”或“不变”,下同),反应的平衡常数___________。
(3)某小组为研究温度对化学平衡移动的影响,设计如图实验。图方案还需补充的是_____________(用文字表达);实验现象为______________________。
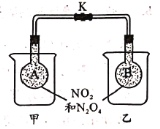
(4)在一定条件下,N2O4和NO2的消耗速率与压强关系为:v(N2O4)=k1·c(N2O4),v(NO2)=k2·c(NO2),设达到平衡时c(N2O4)=1 mol/L,则(1)中反应的平衡常数为_________(用k1、k2表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含铬(+6价)废水严重危害人体健康,工业上常用还原法进行处理。其部分工艺流程如下:

(1)废水中,六价铬以CrO42-;或者Cr2O72-的形式存在,写出其相互转化的离子方程式______。我国常用NaHSO3做还原剂,写出还原池中反应的离子方程式__________。
(2)废水中残留六价铬的浓度随溶液pH变化如图所示。实际生产中需控制pH=2.5~3.0,原因可能是_____________。

(3)沉淀池中生成Cr(OH)3的颗粒太细,为促使其更好地沉淀,可采取的措施是________。
(4)我国规定,工业废水中含Cr(VI)量的排放标准为0.1 mg/L。已知:Cr的相对原子质量为52,Kap(BaCrO4)=1.2×10-10。若用Ba2+除去废水中的CrO42-,达到废水排放标准时,废水中Ba2+浓度最低为___________mol/L(保留小数点后2位)。用Ba2+除去废水中的CrO42-是否可行,为什么?请简要回答。________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】减弱温室效应的方法之一是将CO2回收利用,科学家研究利用回收的CO2制取甲醛,反应的热化学方程式为CO2(g)+2H2(g)CH2O(g)+H2O(g) H。请回答下列问题:
(1)己知:
①CH2O(g)+O2(g)=CO2(g)+H2O(g) H1=-480kJ/mol
②相关化学键的键能数据如表所示:
化学键 | O=O | H-H | O-H |
键能/kJmol-1 | 498 | 436 | 464 |
则CO2(g)+2H2(g)CH2O(g)+H2O(g) H=____________
(2)一定条件下,将n(CO2):n(H2)=1:2的混合气体充入恒温恒容的密闭容器中,发生反应CO2(g)+2H2(g)CH2O(g)+H2O(g)。
①下列说明反应已经达到平衡状态的是____(填选项字母)。
a.容器内气体密度保持不变 b.H2O的体积分数保持不变
c.该反应的平衡常数保持不变 d.混合气体的平均相对分子质量不变
②下列措施既能提高H2的转化率又能加快反应速率的是_____填选项字母)
a.升高温度 b.使用高效催化剂 c.缩小容器体积 d.扩大容器体积
(3)实验室在2L密闭容器中进行模拟上述合成CH2O的实验。T1℃时,将体积比为1:4的CO2和H2混合气体充入容器中,每隔一定时间测得容器内气体压强如表所示:
时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
压强/kPa | 1.08 | 0.96 | 0.88 | 0.82 | 0.80 | 0.80 | 0.80 |
①已知:vp(B)=![]() 则反应开始10 min内,用H2的压强变化表示该反应的平均反应速率为 ___kPamin-1。
则反应开始10 min内,用H2的压强变化表示该反应的平均反应速率为 ___kPamin-1。
②T1℃时,反应的平衡常数Kp的代数式为Kp=_______kPa-1(Kp为用各气体分压表示的平衡常数,分压=总压×物质的量分数)。
(4)T2℃时,向体积为2L的恒容密闭容器中充入一定量的H2和CO2的混合气体,容器内气体压强为1.2 kPa,反应达到平衡时,CH2O的分压与起始的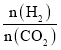 关系如图所示:
关系如图所示:
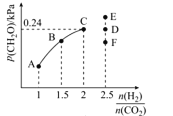
①当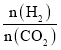 =2时,反应达到平衡后,若再向容器中加入CO2(g)和H2O(g),使二者分压均增大0.05 kPa,则达到新平衡时,H2的转化率将_______(填“增大”“减小”或“不变”)。
=2时,反应达到平衡后,若再向容器中加入CO2(g)和H2O(g),使二者分压均增大0.05 kPa,则达到新平衡时,H2的转化率将_______(填“增大”“减小”或“不变”)。
②当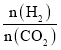 =2.5时,达到平衡状态后,CH2O的分压可能是图象中的点____(填“D”“E”或“F”),原因为_______
=2.5时,达到平衡状态后,CH2O的分压可能是图象中的点____(填“D”“E”或“F”),原因为_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物 YX2、ZX2 中,X、Y、Z 的核电荷数小于 18;X 原子最外能层的 p 能级中有一个轨道充填了 2 个电子,Y 原子的最外层中 p 能级的电子数等于前一能层电子总数,且X 和 Y 具有相同的电子层数;Z 与 X 在周期表中位于同一主族。回答下列问题:
(1)X 的电子排布式为______________,Y 的价电子轨道表示式为_______。
(2)ZX2 的分子式是_______,YX2 电子式是_______ 。
(3)Z 形成的简单阴离子的结构示意图是___________。
(4) Y 和 Z 一定条件下形成简单分子的结构式是___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com