
【题目】下列物质中,含有极性键但属于非极性分子的是( )
A. CO2 B. H2O C. O2 D. HCl
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(含氧化铝、氧化铁)制取铝的过程如下:
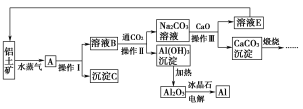
请回答下列问题:
(1)请说出沉淀C在工业上的一种用途:_____________________。
(2)生产过程中,除NaOH、H2O可以循环使用外,还可以循环使用的物质有_____(填化学式)。
(3)操作Ⅰ、操作Ⅱ和操作Ⅲ都是________(填操作名称)。实验室洗涤Al(OH)3沉淀的方法是__________________________________________。
(4)电解熔融的氧化铝,若得到标准状况下22.4 L O2,则同时生成铝的质量为________g。
(5)写出Na2CO3溶液与CaO反应的离子方程式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国首个空间实验室——“天宫一号”的供电系统中,有再生氢氧燃料电池(RFC),工作原理如下图所示,a、b、c、d均为Pt电极。

下列说法正确的是
A. B区的OH通过隔膜向a电极移动,A区pH增大
B. c是正极,电极上的电极反应为:2H++2e![]() H2↑
H2↑
C. 图中右管中的OH通过隔膜向c电极移动,d电极上发生氧化反应
D. 当有1 mol电子转移时,标准状况下,b电极理论上产生气体Y的体积为11.2 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验(已知: NH4++OH-![]() NH3↑+ H2O):
NH3↑+ H2O):
(1)第一份加入AgNO3溶液有沉淀产生;(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol;(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27 g,经足量盐酸洗涤、干燥后,沉淀质量为2.33 g。根据上述实验,以下推测正确的是( )
A. K+一定存在,且100mL溶液中n(K+)≥0.02 mol
B. 100mL溶液中含0.01mol CO32-
C. Cl-一定存在
D. Ba2+一定不存在,Mg2+可能存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O5是一种新型硝化剂,在一定温度下可发生下列反应:2N2O5(g) ![]() 4NO2(g)+O2(g) ΔH>0,T1温度下的部分实验数据为:
4NO2(g)+O2(g) ΔH>0,T1温度下的部分实验数据为:
t/s | 0 | 500 | 1000 | 1500 |
c(N2O5)/(mol·L-1) | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法不正确的是( )
A. 500 s内N2O5分解速率为2.96×10-3 mol·L-1·s-1
B. 其他条件不变,T2温度下反应到1000s时测得N2O5(g)浓度为2.98 mol·L-1,则T1<T2
C. T1温度下的平衡常数为K1=125,1000s时转化率为50%
D. T1温度下的平衡常数为K1,T3温度下的平衡常数为K3,若K1>K3,则T1>T3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲~庚等元素在周期表中的相对位置如下表,己的最高价氧化物的水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数。下列判断正确的是( )
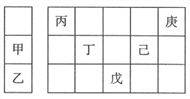
A. 丙与戊的原子序数相差25 B. 气态氢化物的稳定性:庚<己<戊
C. 丁的最高价氧化物可用于制造光导纤维 D. 常温下,甲和乙的单质能与水剧烈反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五氧化二钒(V2O5,摩尔质量为182g·mol-1)可作化学工业中的催化剂,广泛用于冶金、化工等行业。V2O5是一种橙黄色片状晶体,微溶于水,不溶于乙醇,具有强氧化性,属于两性氧化物。某研究小组将从某粗钒(主要含有V2O5,还有少量Al2O3、Fe2O3)中提取V2O5。实验方案设计如下:

已知:NH4VO3是白色粉末,微溶于冷水,可溶于热水,不溶于乙醇、醚。
2NH4VO3![]() V2O5+2NH3↑+H2O
V2O5+2NH3↑+H2O
请回答:
(1)第①步操作的实验装置如右图所示,虚线框中最为合适的仪器是________。(填编号)
![]()
![]()
![]()
![]()

(2)调节pH为8~8.5的目的________。
(3)第④步洗涤操作时,可选用的洗涤剂_________。(填编号)
A.冷水 B.热水 C.乙醇 D.1%NH4Cl溶液
(4)第⑤步操作时,需在流动空气中灼烧的可能原因________。
(5)硫酸工业中,SO2转化为SO3的催化剂就选用V2O5,催化过程经两步完成,将其补充完整:________(用化学方程式表示),4VO2+O2=2V2O5。
(6)将0.253g产品溶于强碱溶液中,加热煮沸,调节pH为8~8.5,向反应后的溶液中加入硫酸酸化的KI溶液(过量),溶液中含有V3+,滴加指示剂,用0.250mol·L-1Na2S2O3溶液滴定,达到终点消耗Na2S2O3标准溶液20.00mL,则该产品的纯度为________。(已知:I2+2Na2S2O3=Na2S4O6+2NaI)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四个试管中都装有5mL0.1mol·L-1Na2S2O3溶液,分别在不同温度下加入0.1mol·L-1硫酸和一定量水,最先出现浑浊的是( )
A.20℃,10mL硫酸B.20℃,5mL硫酸,5mL水
C.30℃,5mL硫酸,2mL水D.30℃,4mL硫酸,3mL水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com