
【题目】混合动力汽车(HEV)中使用了镍氢电池,其工作原理如图所示,其中M为储氢合金,MH为吸附了氢原子的储氢合金,KOH溶液作电解液。关于镍氢电池,下列说法不正确的是
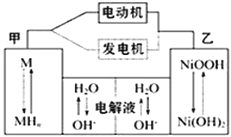
A. 发电机充电时,阴极附近pH降低
B. 电动机工作时溶液中OH﹣向甲移动
C. 放电时正极反应式为:NiOOH+H2O+e-═Ni(OH)2+OH-
D. 电极总反应式为:MH+NiOOH![]() M+Ni(OH)2
M+Ni(OH)2
【答案】A
【解析】
MH为吸附氢原子的储氢合金,M为储氢合金,根据装置图,甲为负极,电极反应式为MH-e-+OH-=M+H2O,乙电极反应为正极,电极反应式为NiOOH+H2O+e-=Ni(OH)2+OH-,然后进行分析即可;
MH为吸附氢原子的储氢合金,M为储氢合金,根据装置图,甲为负极,电极反应式为MH-e-+OH-=M+H2O,乙电极反应为正极,电极反应式为NiOOH+H2O+e-=Ni(OH)2+OH-,
A、充电时,电池的正极接电源的正极,电池的负极接电源的负极,即阴极反应式为M+H2O+e-=MH+OH-,阴极附近pH增大,故A说法错误;
B、电动机工作,该装置为电池,根据原电池工作原理,OH-向负极移动,即向甲移动,故B说法正确;
C、根据上述分析,正极反应式为NiOOH+H2O+e-=Ni(OH)2+OH-,故C说法正确;
D、电极总反应式为MH+NiOOH![]() M+Ni(OH)2,故D说法正确;
M+Ni(OH)2,故D说法正确;


科目:高中化学 来源: 题型:
【题目】为了探究化学能与热能的转化,某实验小组设计了如下三套实验装置:

(1)上述3个装置中,不能证明“铜与浓硝酸反应是吸热反应还是放热反应”的是_______。(填“Ⅰ”“Ⅱ”或“Ⅲ”)
①M为钠,则实验过程中烧杯中可观察到的现象是__________________;
②观察到烧杯里产生气泡,则说明M溶于水______(填“一定是放热反应”“一定是吸热反应”或“可能是放热反应”),理由是_____________________________;
③若观察到烧杯里的玻璃管内形成一段水柱,则M可能是_______________。
(2)某同学选用装置Ⅰ进行实验(实验前U形管里液面左右相平),在甲试管里加入适量氢氧化钡溶液与稀硫酸,U形管中可观察到的现象是________________,说明该反应属于______(填“吸热”或“放热”)反应。
(3)为探究固体M溶于水的热量变化情况,选择装置Ⅱ进行实验(在甲中进行)。M为钠,则实验过程中烧杯中可观察到的现象是_________________;
(4)至少有两种实验方法能证明超氧化钾与水的反应(4KO2+2H2O=4KOH+3O2↑)是放热反应还是吸热反应。
方法①:选择上述装置__________(填“Ⅰ”“Ⅱ”或“Ⅲ”)进行实验;
方法②:取适量超氧化钾粉末用脱脂棉包裹并放在石棉网上,向脱脂棉上滴加几滴蒸馏水,片刻后,若观察到棉花燃烧,则说明该反应是________反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成气是H2和CO的混合气体,工业上可以用于合成氨、生产低级醇等,请回答下列相关问题。
(1)sparg工艺是生产合成气的方法之一,该方法可将甲烷和二氧化碳在高温下转化为H2和CO,该反应的化学方程式为___________。
(2)工业生产中用合成气合成乙醇的反应为2CO(g)+4H2(g)![]() C2H5OH(g)+H2O(g) △H=akJ/mol①生产过程中会发生副反应2CO(g)+3H2(g)
C2H5OH(g)+H2O(g) △H=akJ/mol①生产过程中会发生副反应2CO(g)+3H2(g)![]() CH3CHO(g)+H2O(g) △H=b kJ/mol②
CH3CHO(g)+H2O(g) △H=b kJ/mol②
又已知2H2(g)+O2(g)=2H2O(g) △H=ckJ/mol③
则C2H5OH(g)催化氧化生成CH3CHO(g)和水蒸气的热化学方程式为__________________。
(3)向2L的恒温恒容密闭容器中充入4 molCO和6molH2,若只发生反应①,达平衡时容器中压强是起始压强的0.6倍,则CO的平衡转化率为___________,该温度下反应①的平衡常数等于___________。下列选项不能证明反应①达到平衡状态的是___________(填标号)。
A.混合气体的平均分子量不再改变
B混合气体的密度不再改变
C.CO和H2的物质的量之比不再改变
D.每断开4 molH-H键的同时断开3 mol H-O键
(4)以醋酸为溶剂,甲醇与合成气可以转化为乙醇,同时会生成醚类、酯类等副产物,下图是醋酸与甲醇的质量比对生产的影响,则工业生产中醋酸与甲醇的最佳质量比是___________。随着醋酸和甲醇的质量比增大,一定范围内甲醇的转化率升高而醚类选择性降低的原因可能是___________(从平衡移动角度解释)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Se 元素是人类必须的微量元素之一。下列说法不正确的是
A.SeO2 可以被氧化B.H2Se 比 H2S 不稳定
C.Se 原子的半径比 Cl 原子大D.是性质最接近金属的非金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学概念在逻辑上存在如下关系:

对下列概念的说法正确的是( )
A. 化合物与纯净物属于重叠关系
B. 化合物与碱性氧化物属于交叉关系
C. 分解反应与复分解反应属于并列关系
D. 钠盐与碳酸盐属于并列关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化学家在“铁基(氟掺杂镨氧铁砷化合物)高温超导”材料研究上取得了重要成果,该研究项目荣获2013年度“国家自然科学奖”一等奖。
(1)基态砷原子的价电子排布式为____。
(2)氟、氧、砷三种元素的电负性由大到小的顺序是____(用相应的元素符号填空)。
(3)Fe(SCN)3溶液中加人NH4F,发生如下反:Fe(SCN)3+6NH4F=== (NH4)3FeF6+3NH4SCN
①NH4F 中阳离子的立体构型为____。
②(NH4)3FeF6存在的微粒间作用力有__(选填序号,下同)。
a.离子键 b.共价键 c.金属键 d.配位键 e.范德华力 f.氢键
③已知SCN中各原子最外层均满足8电子稳定结构,则C原子的杂化方式为____,该原子团中σ与π键个数比为____。
(4)FeCl3晶体易溶于水、乙醇,受热易气化,而FeF3晶体熔点高于1000oC,试解释两种化合物熔点差异较大的原因:____。
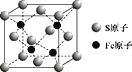
(5)S和Fe形成的某化合物,其晶胞如图所示,则该物质的化学式为 ___。设该晶胞的密度为ρ g/cm3,用NA表示阿伏加德罗常数,则该晶胞中距离最近的S原子之间的距离为(列出计算式即可)____cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是( )
A. 常温常压,两种气体的密度之比等于摩尔质量之比
B. 在同温同体积下,两种气体的物质的量之比等于压强之比
C. 在标准状况下,两种气体的体积之比等于摩尔质量之比
D. 在同温同压下,同体积的两种气体的质量之比等于摩尔质量之比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既是氧化还原反应,又是放热反应的是( )
A. 锌粒与稀硫酸的反应B. 高温煅烧石灰石的反应
C. 生石灰与水的反应D. 灼热的炭与CO2的反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com