
【题目】我国化学家在“铁基(氟掺杂镨氧铁砷化合物)高温超导”材料研究上取得了重要成果,该研究项目荣获2013年度“国家自然科学奖”一等奖。
(1)基态砷原子的价电子排布式为____。
(2)氟、氧、砷三种元素的电负性由大到小的顺序是____(用相应的元素符号填空)。
(3)Fe(SCN)3溶液中加人NH4F,发生如下反:Fe(SCN)3+6NH4F=== (NH4)3FeF6+3NH4SCN
①NH4F 中阳离子的立体构型为____。
②(NH4)3FeF6存在的微粒间作用力有__(选填序号,下同)。
a.离子键 b.共价键 c.金属键 d.配位键 e.范德华力 f.氢键
③已知SCN中各原子最外层均满足8电子稳定结构,则C原子的杂化方式为____,该原子团中σ与π键个数比为____。
(4)FeCl3晶体易溶于水、乙醇,受热易气化,而FeF3晶体熔点高于1000oC,试解释两种化合物熔点差异较大的原因:____。
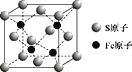
(5)S和Fe形成的某化合物,其晶胞如图所示,则该物质的化学式为 ___。设该晶胞的密度为ρ g/cm3,用NA表示阿伏加德罗常数,则该晶胞中距离最近的S原子之间的距离为(列出计算式即可)____cm。
【答案】4S24P3 F>O>As 正四面体 abd sp 1:1 FeF3为离子晶体,FeCl3为分子晶体 FeS ![]()
【解析】
(1)主族元素基态原子的价层电子排布就是最外层电子排布,所以基态砷原子的价层电子排布式为4s24p3,故答案为:4s24p3;
(2)非金属性越强,电负性越大,所以氟、氧、砷三种元素电负性值由大到小的顺序是F>O>As,故答案为:F>O>As;
(3)①NH4+中价层电子对=4+![]() =4,所以中心原子原子轨道为sp3杂化,该离子中含有不孤电子对,所以其空间构型为正四面体,故答案为:正四面体;
=4,所以中心原子原子轨道为sp3杂化,该离子中含有不孤电子对,所以其空间构型为正四面体,故答案为:正四面体;
②(NH4)3FeF6是离子化学物,铵根离子与六氟合铁酸根之间是离子键,氮与氢之间是共价键,铁与氟之间是配位键,故答案为:abd;
③SCN-中各原子最外层均满足8电子稳定结构,该原子团的结构式为[S=C=N]-,其结构与二氧化碳相似,其中含有2个σ键与2个π键,所以C原子的杂化方式为sp,σ键与π键个数的比为1:1,故答案为:sp;1:1;
(4)FeCl3晶体易溶于水、乙醇,用酒精灯加热即可气化,所以FeCl3是分子晶体,FeF3晶体熔点高于1000°C,所以FeF3是离子晶体;分子晶体中分子之间是范德华力,作用力比较小,而离子键的作用力较大,所以两者的沸点相差较大,故答案为:FeCl3是分子晶体,FeF3是离子晶体;
(5)该晶胞中Fe原子个数是4,S原子个数=![]() ,根据S和Fe原子个数之比确定化学式为FeS;该晶胞的质量m=
,根据S和Fe原子个数之比确定化学式为FeS;该晶胞的质量m=![]() =
=![]() ,该晶胞的体积=
,该晶胞的体积=![]() =
=![]() cm3;晶胞棱长=
cm3;晶胞棱长=![]() cm=
cm=![]() 该晶胞中距离最近的S原子之间的距离为晶胞棱长的
该晶胞中距离最近的S原子之间的距离为晶胞棱长的![]() 倍,即
倍,即![]() ×
×![]() cm。
cm。
故答案为:FeS;![]() ×
×![]() cm。
cm。


 灵星计算小达人系列答案
灵星计算小达人系列答案科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A. 若图1表示0.2mo1MgCl2·6H2O在空气中充分加热时固体质量随时间的变化,则a为19.0
B. 若图2表示常温下用0.1000mo1/L NaOH溶液滴定25.00mL CH3COOH溶液的滴定曲线,则c(CH3COOH)=0.1000mo1/L
C. 若图3表示常温下稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则常温下,NaA溶液的pH小于同浓度的NaB溶液的pH
D. 若图4表示恒温恒容条件下,反应2NO2(g)![]() N2O4(g)中,各物质的浓度与其消耗速率之间的关系,则b点对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,则b点对应的状态为化学平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法错误的是
A. NaCl晶胞中Na+的配位数为6且构成正八面体
B. 由石墨比金刚石稳定可知:C(金刚石,s) ===C(石墨,s) ΔH>0
C. 已知冰的熔化热为6.0 kJ/mol,冰中氢键键能为20 kJ/mol。假设熔化热完全用于打破冰的氢键,最多能破坏冰中15%的氢键,则每摩尔冰中平均有2 mol氢键
D. 石墨中的碳原子采用sp2杂化构成平面层状结构,12g石墨中碳碳键数为1.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C是常见的三种单质,A、B、C及其他物质之间的反应关系如图所示,其中B、D、E、F的水溶液呈酸性。若D+C→E+F,且常温下只有B为气态,则A、B、C分别为

A. Fe、Cl2、Cu
B. Fe、Cl2、H2
C. Cu、Cl2、Fe
D. Fe、Cl2、Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】混合动力汽车(HEV)中使用了镍氢电池,其工作原理如图所示,其中M为储氢合金,MH为吸附了氢原子的储氢合金,KOH溶液作电解液。关于镍氢电池,下列说法不正确的是
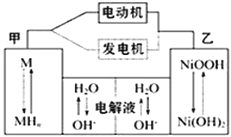
A. 发电机充电时,阴极附近pH降低
B. 电动机工作时溶液中OH﹣向甲移动
C. 放电时正极反应式为:NiOOH+H2O+e-═Ni(OH)2+OH-
D. 电极总反应式为:MH+NiOOH![]() M+Ni(OH)2
M+Ni(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和H2在一定条件下合成甲醇的反应为:CO(g)+2H2(g)![]() CH3OH(g) ΔH。现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1molCO和2molH2的混合气体,控温,进行实验,测得相关数据如下图1和图2。下列叙述不正确的是
CH3OH(g) ΔH。现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1molCO和2molH2的混合气体,控温,进行实验,测得相关数据如下图1和图2。下列叙述不正确的是

A. 该反应的ΔH<0
B. 在500℃条件下达平衡时CO 的转化率为60%
C. 平衡常数K1(3000C)<K2(5000C)
D. 图2中达化学平衡的点为c、d、e
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,电子转移发生在同种物质的同种元素之间的是( )
A. 2H2S+SO2=3S+2H2OB. 2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
C. 2KClO3![]() 2KCl+3O2↑D. Cu2O+H2SO4=CuSO4+Cu+H2O
2KCl+3O2↑D. Cu2O+H2SO4=CuSO4+Cu+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用图所示装置检验乙烯时不需要除杂的是

乙烯的制备 | 试剂X | 试剂Y | |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
C | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
D | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | Br2的CCl4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式书写正确的是( )
A. H2S 的电离方程式:H2S+H2O![]() H3O++HS-
H3O++HS-
B. NaHCO3在水溶液中的电离方程式:NaHCO3= Na++H++CO32-
C. CO32-的水解方程式:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D. HS-的水解方程式:HS-+H2O![]() S2-+H3O+
S2-+H3O+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com