
【题目】下列图示与对应的叙述相符的是

A. 若图1表示0.2mo1MgCl2·6H2O在空气中充分加热时固体质量随时间的变化,则a为19.0
B. 若图2表示常温下用0.1000mo1/L NaOH溶液滴定25.00mL CH3COOH溶液的滴定曲线,则c(CH3COOH)=0.1000mo1/L
C. 若图3表示常温下稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则常温下,NaA溶液的pH小于同浓度的NaB溶液的pH
D. 若图4表示恒温恒容条件下,反应2NO2(g)![]() N2O4(g)中,各物质的浓度与其消耗速率之间的关系,则b点对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,则b点对应的状态为化学平衡状态
【答案】C
【解析】
A.MgCl2为强酸弱碱盐,其结晶水合物在空气中加热最终转化为氧化镁,根据Mg元素守恒,0.2mo1MgCl2·6H2O 分解产生0.2molMgO,其质量m(MgO)=0.2mol×40g/mol=8.0g,最终生成质量应为8.0g,A错误;
B.0.1000 mol/L的NaOH溶液滴定25.00 mLCH3COOH,当溶液pH=7时,溶液中c(H+)=c(OH-),若酸碱恰好中和,溶液为醋酸钠溶液,由于醋酸是一元弱酸,醋酸钠是强碱弱酸盐,在溶液中CH3COO-水解使溶液呈碱性,实际上溶液为中性,说明此时溶液中应同时存在醋酸和醋酸钠,由于醋酸并未完全反应,所以无法计算醋酸的浓度,B错误;
C.常温下,稀释HA、HB两种酸的稀溶液,溶液酸性越强,溶液稀释时,其pH变化幅度越大,根据图象可知,酸性:HA>HB。酸的酸性越强,其对应的强碱盐的碱性就越弱,则NaA的碱性比NaB弱,则同浓度的两溶液的pH:NaA<NaB,C正确;
D.恒温恒容条件下,发生可逆反应:2NO2(g)![]() N2O4(g),根据图象,b点表示消耗N2O4的速率等于NO2的消耗速率,表明逆反应速率大于正反应速率,反应逆向进行,不是化学平衡状态,D错误;
N2O4(g),根据图象,b点表示消耗N2O4的速率等于NO2的消耗速率,表明逆反应速率大于正反应速率,反应逆向进行,不是化学平衡状态,D错误;
故合理选项是C。


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示。下列说法错误的是
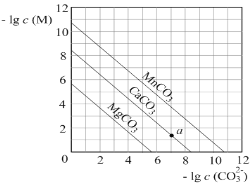
A. Ksp(MnCO3)的数量级为10-11
B. MgCO3的悬浊液中加入少量水充分振荡,c(Mg2+)不变
C. a点表示的溶液中,c(Ca2+)>c(CO32-)
D. 向浓度均为0.01mol·L-1的Mg2+、Ca2+、Mn2+混合溶液中逐滴加入Na2CO3溶液,最先形成MgCO3沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蒸馏碘滴定法可测量中药材中二氧化硫是否超标(亚硫酸盐折算成二氧化硫)。原理是利用如图装置将亚硫酸盐转化为SO2,然后通过碘标准溶液滴定吸收液。

实验步骤如下:
I.SO2含量的测定
烧瓶A中加中药粉10g,加蒸馏水300 mL; 锥形瓶中加蒸馏水125mL和淀粉试液1mL作为吸收液; 打开冷凝水,通氮气,滴入盐酸10mL; 加热烧瓶A并保持微沸约3min后,用0.01000mol/L 碘标准溶液一边吸收一边滴定,至终点时消耗碘标准溶液V1mL;
Ⅱ.空白实验
只加300mL蒸馏水,重复上述操作,需碘标准溶液体积为V0mL.
(1)仪器C的名称______。仪器B的入水口为_______(填“a”或“b”)。
(2)滴入盐酸前先通氮气一段时间作用是________,测定过程中氮气的流速过快会导致测量结果______。(填“偏大”“偏小”“不变”)
(3)①滴定过程中使用的滴定管为_________。
A.酸式无色滴定管 B.酸式棕色滴定管 C.碱式无色滴定管 D.碱式棕色滴定管
②滴定时锥形瓶中反应的离子方程式为________,滴定终点的现象是________。
(4)空白实验的目的是________。
(5)该中药中含SO2含量为________mg/ kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示化学反应过程中的能量变化,据图判断下列说法中合理的是( )

A.500mL 2.0mol·L-1 HCl和500mL 2.0mol·L-1 NaOH的反应符合图1,且ΔE=57.3kJ
B.500mL 2.0mol·L-1 H2SO4和500mL 2.0mol·L-1 Ba(OH)2的反应符合图2,且ΔE=114.6kJ
C.发生图1能量变化的任何反应,一定不需加热即可发生
D.CaO、浓硫酸溶于水时的能量变化符合图1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究化学能与热能的转化,某实验小组设计了如下三套实验装置:

(1)上述3个装置中,不能证明“铜与浓硝酸反应是吸热反应还是放热反应”的是_______。(填“Ⅰ”“Ⅱ”或“Ⅲ”)
①M为钠,则实验过程中烧杯中可观察到的现象是__________________;
②观察到烧杯里产生气泡,则说明M溶于水______(填“一定是放热反应”“一定是吸热反应”或“可能是放热反应”),理由是_____________________________;
③若观察到烧杯里的玻璃管内形成一段水柱,则M可能是_______________。
(2)某同学选用装置Ⅰ进行实验(实验前U形管里液面左右相平),在甲试管里加入适量氢氧化钡溶液与稀硫酸,U形管中可观察到的现象是________________,说明该反应属于______(填“吸热”或“放热”)反应。
(3)为探究固体M溶于水的热量变化情况,选择装置Ⅱ进行实验(在甲中进行)。M为钠,则实验过程中烧杯中可观察到的现象是_________________;
(4)至少有两种实验方法能证明超氧化钾与水的反应(4KO2+2H2O=4KOH+3O2↑)是放热反应还是吸热反应。
方法①:选择上述装置__________(填“Ⅰ”“Ⅱ”或“Ⅲ”)进行实验;
方法②:取适量超氧化钾粉末用脱脂棉包裹并放在石棉网上,向脱脂棉上滴加几滴蒸馏水,片刻后,若观察到棉花燃烧,则说明该反应是________反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2、N2合成NH3的反应中,当分别用以下各种物质表示反应速率时,则反应速率最快的是
A. v(N2)=0.6mol/(L·min)B. v(NH3)=0.9mol/(L·min)
C. v(H2)=1.2mol/(L·min)D. v(H2)=0.025mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X和Y中,X原子的最外层电子数是内层电子总数的一半,Y元素在X元素的前一周期,Y2离子和Ne原子的电子层结构相同。有关X和Y形成的化合物Z的说法中,正确的是
A. Z肯定不是酸酐B. Z是一种碱性氧化物
C. Z的分子式可能是X2Y5D. Z是一种离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂电池在充电时因容易形成枝晶而导致稳定性和安全性存在问题,近日我国多个科研部门联合研究出了一种锂钠合金作负极材料的 Li/Na-O2电池,该电池使用了三氟甲磺酸钠(NaCF3SO3)的四乙二醇二甲醚( TEGDME)溶液作为电解液,其简化结构如图所示,电池工作时正极材料表面生成Li2O2和Na2O2,下列说法错误的是

A. 外电路中电子由锂钠合金电极移向碳纳米管电极
B. 电解液中的溶剂四乙二醇二甲醚不能换成水
C. 电池工作时消耗标准状况下的22.4LO2,转移电子数为4NA
D. 充电时阳极反应之一是Na2O2-2e-=2Na++O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化学家在“铁基(氟掺杂镨氧铁砷化合物)高温超导”材料研究上取得了重要成果,该研究项目荣获2013年度“国家自然科学奖”一等奖。
(1)基态砷原子的价电子排布式为____。
(2)氟、氧、砷三种元素的电负性由大到小的顺序是____(用相应的元素符号填空)。
(3)Fe(SCN)3溶液中加人NH4F,发生如下反:Fe(SCN)3+6NH4F=== (NH4)3FeF6+3NH4SCN
①NH4F 中阳离子的立体构型为____。
②(NH4)3FeF6存在的微粒间作用力有__(选填序号,下同)。
a.离子键 b.共价键 c.金属键 d.配位键 e.范德华力 f.氢键
③已知SCN中各原子最外层均满足8电子稳定结构,则C原子的杂化方式为____,该原子团中σ与π键个数比为____。
(4)FeCl3晶体易溶于水、乙醇,受热易气化,而FeF3晶体熔点高于1000oC,试解释两种化合物熔点差异较大的原因:____。
(5)S和Fe形成的某化合物,其晶胞如图所示,则该物质的化学式为 ___。设该晶胞的密度为ρ g/cm3,用NA表示阿伏加德罗常数,则该晶胞中距离最近的S原子之间的距离为(列出计算式即可)____cm。
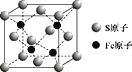
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com