
【题目】用系统命名法给下列化合物命名:
(1)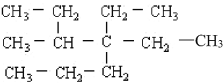 ______________________________
______________________________
(2)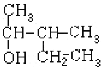 ______________________________
______________________________
(3)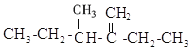 ______________________________
______________________________
(4)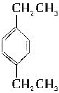 ___________________________
___________________________
【答案】3-甲基-4,4-二乙基庚烷 3-甲基-2-戊醇 3-甲基-2-乙基-1-戊烯 1,4-二乙基苯
【解析】
(1)选择分子中含有C原子数最多的碳链为主链,该物质分子中最长碳链上含有7个C原子,从左端开始给主链上的C原子编号,可确定在主链的第3号C原子上有1个甲基,在第4号C原子上有2个乙基,故该物质名称为3-甲基-4,4-二乙基庚烷;
(2)选择含有羟基在内的最长碳链为主链,该物质分子中主链上有5个C原子,从左端开始给主链C原子编号,可确定羟基连接在主链的2号C原子上,甲基在3号C原子上,则该醇名称为3-甲基-2-戊醇;
(3)选择含有碳碳双键在内的最长的碳链为主链,该物质分子中含有碳碳双键的最长的碳链上有5个C原子,碳碳双键在1、2号碳原子之间,2号C原子上连有1个乙基,3号C原子上有1个甲基,根据简单取代基写在前面,复杂取代基写在后面,该物质名称为3-甲基-2-乙基-1-戊烯;
(4)该分子中的2个乙基在苯环上相对位置,以其中一个乙基连接的苯环C原子为1号C原子,则另一个乙基连接苯环C原子的位置为4号C原子,因此该物质名称为1,4-二乙基苯。


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案科目:高中化学 来源: 题型:
【题目】氧化亚氮(N2O)是一种强温室气体,且易转换成颗粒污染物。研究氧化亚氮分解对环境保护有重要意义。
(1)污水生物脱氮过程中,在异养微生物催化下,硝酸铵可分解为N2O和另一种产物,该反应的化学方程式为___。
(2)已知反应2N2O(g)=2N2(g)+O2(g)的△H=-163kJ/mol,1molN2(g),1molO2(g)分子中化学键断裂时分别需要吸收945kJ,498kJ的能量,则1molN2O(g)分子中化学键断裂时需要吸收的能量为___kJ。
(3)在一定温度下的恒容容器中,反应2N2O(g)=2N2(g)+O2(g)的部分实验数据如下:
反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
c(N2O)/molL-1 | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 | 0.040 | 0.030 | 0.020 | 0.010 | 0.010 |
①在0~20min时段,反应速率v(N2O)为___molL-1min1。
②若N2O起始浓度c0为0.150 molL-1,则反应至30min时N2O的转化率α=___。比较不同起始浓度时N2O的分解速率:v(c0=0.150molL-1)___v(c0=0.001molL-1)(填“>”、“=”或“<”)。
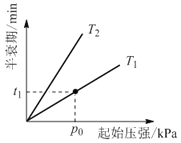
③不同温度(T)下,N2O分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O消耗一半时所需的相应时间),则T1____T2(填“>”、“=”或“<”)。当温度为T1、起始压强为p0,反应至t1min时,体系压强p=___(用p0表示)。
(4)碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步 I2(g) ![]() 2I(g) (快反应)
2I(g) (快反应)
第二步 I(g)+N2O(g)→N2(g)+IO(g) (慢反应)
第三步 IO(g)+N2O(g)→N2(g)+O2(g)+I(g) (快反应)
实验表明,含碘时N2O分解速率方程v=kc(N2O)[c(I2)]0.5(k为速率常数)。下列表述正确的是___(填标号)。
A.N2O分解反应中,k(含碘)>k(无碘)
B.第一步对总反应速率起决定作用
C.第二步活化能比第三步大
D.I2浓度与N2O分解速率无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将0.03molCl2缓缓通入1L含有0.02molH2SO3和0.02molHBr的混合液中(K1、K2分别表示H2SO3的一、二级电离常数;-lg0.02=1.7),下列图象错误的是( )
A.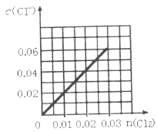 B.
B.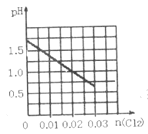
C.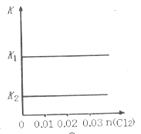 D.
D.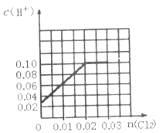
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烯烃在一定条件下可以按下面的框图进行反应:

其中,D是 。F1和F2互为同分异构体,G1和G2互为同分异构体。
。F1和F2互为同分异构体,G1和G2互为同分异构体。
(1)A的结构简式是:____________.
(2)框图中属于取代反应的是(填数字代号):______________.
(3)框图中属于加成反应的是_____________________.
(4)G1的结构简式是:____________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25 ℃时有关弱酸的电离平衡常数见下表:
弱酸化学式 | HA | H2B |
电离平衡常数(25 ℃) | Ka=1.7×10-6 | Ka1=1.3×10-3 Ka2=5.6×10-8 |
则下列有关说法正确的是( )
A.NaHB溶液中部分微粒浓度的大小为:c(Na+)>c(HB-)>c(B2-)>c(H2B)
B.等物质的量浓度的各溶液pH关系为:pH(Na2B)>pH(NaHB)>pH(NaA)
C.向Na2B溶液中加入足量的HA溶液发生反应的离子方程式为:B2-+2HA=2A-+H2B
D.将a mol/L的HA溶液与a mol/L的NaA溶液等体积混合,混合液中:c(Na+)>c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的化学方程式:
(1)苯制备溴苯___________________。
(2)制备TNT_____________________。
(3)2溴丙烷消去反应______________。
(4)实验室制乙烯__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z均为主族元素,分析表中数据,判断下列说法正确的是(a≠b)( )
元素 | X | Y | Z |
最外层电子数 | a | b | a |
原子半径/nm | 0.154 | 0.130 | 0.211 |
A.X与Y位于同一主族,且X在Y的上一周期
B.X与Z位于同一主族,且X在Z的下一周期
C.X与Z位于同一周期,且X的原子序数小于Z的原子序数
D.X与Z位于同一主族,且X的原子序数小于Z的原子序数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体![]() 的化学式为
的化学式为![]() ,它的所有原子的最外层都符合相应稀有气体原子的最外电子层结构,则下列有关说法不正确的是
,它的所有原子的最外层都符合相应稀有气体原子的最外电子层结构,则下列有关说法不正确的是
A.![]() 中既有离子键又有共价键B.
中既有离子键又有共价键B.![]() 的熔、沸点高于
的熔、沸点高于![]()
C.![]() 中含有
中含有![]() 键D.
键D.![]() 形成的晶体是离子晶体
形成的晶体是离子晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,元素周期表的第7周期已被填满。2017年,第113号、115号、117号和118号元素有了中文名称:鉨![]() 、镆
、镆![]() 、
、![]()
![]() 、
、![]()
![]() 。已知第113号元素与
。已知第113号元素与![]() 元素同主族,根据元素周期律的知识,下列预测或说法合理的是
元素同主族,根据元素周期律的知识,下列预测或说法合理的是
A.![]() 的最高价氧化物对应的水化物可能具有两性
的最高价氧化物对应的水化物可能具有两性
B.![]() 在元素周期表中的位置是第7周期第ⅤB族
在元素周期表中的位置是第7周期第ⅤB族
C.![]() 的非金属性比
的非金属性比![]() 的弱
的弱
D.![]() 在元素周期表的所有元素中非金属性最强
在元素周期表的所有元素中非金属性最强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com