
【题目】下列叙述正确的是
A. 液溴易挥发,在存放液溴的试剂瓶中应加水封
B. 能使湿润的淀粉KI试纸变蓝色的物质一定是Cl2
C. 某溶液中加入CCl4,CCl4层显紫色,证明原溶液中存在I—
D. 中和滴定实验时,用待测液润洗锥形瓶
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:
【题目】已知A为一种盐,C、D、F、N、O为无色气体,E常温常压下为无色无味的液体,N、H、L为高中常见的单质,I为常见无氧强酸,M的焰色反应为紫色,反应①常用于气体F的检验。
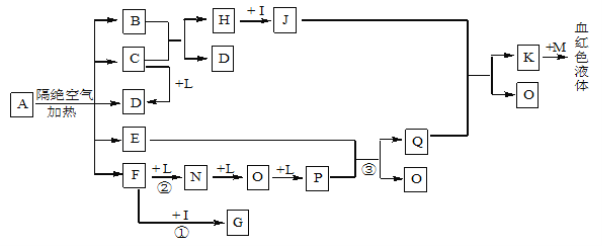
(1)写出D的电子式为_______________;
(2)写出反应①的化学方程式: ;写出反应②的化学方程式: ;反应③中氧化剂和还原剂的物质的量之比为_________________;
(3)将等体积、等浓度的G和F的溶液混合,溶液显碱性,则溶液中离子浓度从大到小的顺序为 ______________________;
(4)检验J中阳离子的实验方法为 ;
(5)已知B中氧元素的质量分数为22.2﹪,且A分解产生的各物质的物质的量之比为n(B):n(C): n(D):n(E):n(F)=1:2:2:1:2,则A的化学式为_________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度T1和T2时,分别将0.50 mol CH4和1.2mol NO2充入1 L的密闭容器中发生反应:
CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g)△H=akJ/mol。测得有关数据如下表:
N2(g)+CO2(g)+2H2O(g)△H=akJ/mol。测得有关数据如下表:
温度 | 时间/min 物质的量 | 0 | 10 | 20 | 40 | 50 |
T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | x | 0.15 |
下列说法正确的是
A.T1>T2,且a>0
B.当温度为T2、反应进行到40 min时, x>0.15
C.温度为T2时,若向平衡后的容器中再充入0.50 mol CH4和1.2mol NO2,重新达到平衡时,n(N2)=0.70mol
D.温度为T1时,达平衡时CH4 的转化率大于NO2的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一瓶Na2SO3溶液,由于可能已部分氧化,某学生进行如下实验:取少量溶液,滴入Ba(NO3)2溶液产生白色沉淀,再加入过量稀硝酸,充分振荡后仍有白色沉淀,结论正确的是
A. Na2SO3溶液已部分氧化
B. 加入Ba(NO3)2溶液后生成的沉淀中一定含有BaSO4
C. 加硝酸后的不溶沉淀一定为BaSO4
D. 此实验能确定Na2SO3溶液是否部分氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在城市地下常埋有纵横交错的管道和运输电线路,有些地面上还铺有地铁或城铁的铁轨,当有电流泄漏入潮湿的土壤中,并与金属管道或铁轨形成回路时,就会引起金属管道、铁轨的腐蚀。原理简化如图所示。则下列有关说法不正确的是
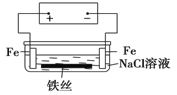
A.原理图可理解为两个串联电解装置
B.如在NaCl溶液中加入酚酞,右边Fe电极附件溶液变红
C.地下管线被腐蚀,不易发现,也不便维修,故应将埋在地下的金属管道表面涂绝缘膜(或油漆等)
D.溶液中铁丝左端电极反应式为:Fe-2e-=Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国有丰富的海水资源,开发和利用海水资源是当前科学研究的一项重要任务,下图是海水综合利用的一个方面。

请回答下列问题:
(1)①步主要反应的的离子方程式:_____________________________。
(2)分离出氢氧化镁的操作为__________,第③步需要加入_________。
(3)将粗食盐中含有的Mg2+、Ca2+和SO42—等杂质除去,加入的试剂有(按加入顺序填入)___________(只要求填一组合理的答案即可) 。
(4)⑤产物氢气在__________极生成,若电解食盐水时消耗NaCl的质量为234g,则在理论上最多可得氯气的体积为 升(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质应用的叙述中,正确的是
A. SiO2用于半导体材料 B. 明矾可以用于自来水的杀菌消毒
C. 过氧化钠可用作潜艇供氧剂 D. 工业上采用电解饱和NaCl溶液制取Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列有关问题。
(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g)=N2(g)+2CO2(g);△H<0,在一定温度下,在一体积固定的密闭容器中充入一定量的NO和CO达到平衡状态。若要同时提高该反应的速率和NO的转化率,采取的措施有 、 。(写出2个)
(2)对反应N2O4(g)![]() 2NO2(g) △H>0 在温度为Tl、T2时平衡体系中NO2的体积分数随压强变化曲线如图所示,下列说法正确的是__________。
2NO2(g) △H>0 在温度为Tl、T2时平衡体系中NO2的体积分数随压强变化曲线如图所示,下列说法正确的是__________。
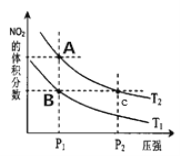
a.A、C两点的反应速率:A>C
b.A、C两点气体的颜色:A浅,C深
c.由状态A到状态B,可以用加热的方法
d.A、C两点的化学平衡常数:A>C
(3)某温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应:3A(g)+2B(g) ![]() 4C(?)+2D(?)。反应一段时间后达到平衡,测得生成1.6 mol C,且反应的前后压强之比为5∶4(相同的温度下测量)。则该反应的化学平衡常数:K=____________。
4C(?)+2D(?)。反应一段时间后达到平衡,测得生成1.6 mol C,且反应的前后压强之比为5∶4(相同的温度下测量)。则该反应的化学平衡常数:K=____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com