
����Ŀ��һ�������£���3molA��1molB�����������ڹ̶��ݻ�Ϊ2L���ܱ������У��������·�Ӧ��3A(g)+B(g)![]() xC(g)+2D(s)��2minĩ�÷�Ӧ�ﵽƽ�⣬����0.8molD�������C��Ũ��Ϊ0.2mol/L�������ж���ȷ����
xC(g)+2D(s)��2minĩ�÷�Ӧ�ﵽƽ�⣬����0.8molD�������C��Ũ��Ϊ0.2mol/L�������ж���ȷ����
A. �ӿ�ʼ��ƽ��A��ƽ����Ӧ����Ϊ0.3mol/(L![]() s)
s)
B. �ӿ�ʼ��ƽ��B��ת����Ϊ60%
C. �˷�Ӧ�Ļ�ѧƽ�ⳣ������ʽ![]()
D. �����������ܶȲ��ٸı�ʱ���÷�Ӧһ���ﵽƽ��״̬
���𰸡�D
�����������������һ�������£���3molA��1molB�����������ڹ̶��ݻ�Ϊ2L���ܱ������У��������·�Ӧ��3A(g)+B(g)![]() xC(g)+2D(s)��2minĩ�÷�Ӧ�ﵽƽ�⣬����0.8molD�������C��Ũ��Ϊ0.2mol/L�����ݻ�ѧƽ������ʽ��ʽ���㣻
xC(g)+2D(s)��2minĩ�÷�Ӧ�ﵽƽ�⣬����0.8molD�������C��Ũ��Ϊ0.2mol/L�����ݻ�ѧƽ������ʽ��ʽ���㣻
3A(g)+B(g)![]() xC(g)+2D(s)
xC(g)+2D(s)
��ʼ��(mol) 3 1 0 0
�仯��(mol) 1.2 0.4 0.4x 0.8
ƽ����(mol) 1.8 0.6 0.4x 0.8
C��Ũ��Ϊ0.2mol/L��C�����ʵ���Ϊ0.4������õ�x=1��A��A��ƽ����Ӧ����=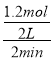 =0.3mol/(Lmin)����A����B��B��ת����=
=0.3mol/(Lmin)����A����B��B��ת����=![]() ��100%=40%����B����C��DΪ���壬�������´˷�Ӧ�Ļ�ѧƽ�ⳣ��=
��100%=40%����B����C��DΪ���壬�������´˷�Ӧ�Ļ�ѧƽ�ⳣ��=![]() ����C����D����Ӧ�������к��й��壬�ܶȵ�����������������������������������ܶȲ��ٸı�ʱ���÷�Ӧһ���ﵽƽ��״̬����D��ȷ����ѡD��
����C����D����Ӧ�������к��й��壬�ܶȵ�����������������������������������ܶȲ��ٸı�ʱ���÷�Ӧһ���ﵽƽ��״̬����D��ȷ����ѡD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�˱������������������Դ��ij�о�С��ͨ�����¼����̣�����ҵ�����������������������Ҫ��![]() ���ڣ�ת�����Ҫ�Ĺ�ҵԭ��
���ڣ�ת�����Ҫ�Ĺ�ҵԭ��![]() ����Ӧ�����ԣ�
����Ӧ�����ԣ�
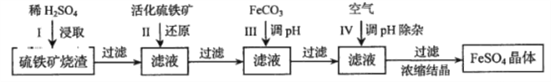
�������ԭFe2������Ҫ��ӦΪ��FeS2��7Fe2(SO4)3��8H2O=15FeSO4��8H2SO4��������������Ӧ����ش��������⣺
��1���ڢ�H2SO4��Fe2O3��Ӧ�����ӷ���ʽ��___________________________��
��2������ڢ���Fe3+�Ƿ���ȫ��ԭ��Ӧѡ��________��������ĸ��ţ���
A.KMnO4��Һ B.����-KI��Һ C.KSCN��Һ
��3���ڢ�FeCO3����ҺpH��5.8���ң�Ȼ���ٵ�VI��ͨ�����ʹ��ҺpH����5.2����ʱFe2������������Һ�����������ʳ�����ͨ�����������ҺpH���͵�ԭ����________________��
��4��FeSO4��ת��ΪFeCO3��FeCO3�ڿ����м��ȷ�Ӧ���Ƶ���ϵ��������ϡ�
��֪25�棬101kPaʱ��
4Fe(s)��3O2(g)=2Fe2O3(s) ��H=-1648kJ/mol
C(s)��O2(g)=CO2(g) ��H=-393kJ/mol
2Fe(s)��2C(s)��3O2(g)=2FeCO3(s) ��H=-1480kJ/mol
FeCO3�ڿ����м��ȷ�Ӧ����Fe2O3���Ȼ�ѧ����ʽ��______________��
��5��FeSO4��һ�������¿��Ƶ�FeS2(��������)���ײ��ϡ��ò��Ͽ��������������﮵�أ���طŵ�ʱ���ܷ�ӦΪ4Li+FeS2=Fe+2Li2S��������Ӧʽ��________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��̽��������ʴ��װ��ͼ�����ֿ�ʼʱU�ι���˺�īˮˮ���½���һ��ʱ���U�ι���˺�īˮˮ��������������˵������ȷ����

A. ���ָ�ʴ�����ĵ缫��Ӧʽ��ΪFe-2e-=Fe2+
B. ��ʼʱ�����������ⸯʴ
C. һ��ʱ���������������ʴ
D. ���ⷴӦ���ܷ�ӦʽΪ2Fe+O2+2H2O=2Fe(OH)2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵������ȷ����
A. 1 mol FeI2������������Ӧʱת�Ƶĵ�����Ϊ2NA
B. ���³�ѹ�£�46gNO2��N2O4������庬�е�ԭ����Ϊ3NA
C. �ڹ���������ˮ�ķ�Ӧ�У�ÿ����0.1mol������ת�Ƶ�����Ϊ0.4 NA
D. ������56 g��ƬͶ������ŨH2SO4������NA��SO2����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ƭ��̼���õ�������ƽ�з���ϡ�����У���Ƭ�� ��
A. ������ B. �Ǹ��� C. �õ����� D. ������ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���ԭ��ص������У���ȷ���ǣ� ��
A. �������������� B. �������ϲ������Ӿ���������
C. ����������ԭ��Ӧ D. �缫ֻ�������ֲ�ͬ�Ľ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�ǰ������Ȼ��ⷴӦ��װ�á����߲���Ƭ��ַ�Ӧ����Ӧ���й���������������ȷ����(NA��ʾ�����ӵ�����)(����)

A�����巴Ӧ��������Ϊ0.224 L
B��������ķ��Ӹ���Ϊ0.005NA
C���������е�N��H������Ϊ0.02NA
D����ˮ�ܽ��������Һ��NH4+��ĿΪ0.005NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ˮ�ĺ���Լռ65%������ѡ��������ȷ˵��ˮ��������Ҫ�Ե��� ( )
��ˮ�����ࡢ�����ʡ�֬��һ����Ϊ�����ṩ����
��û��ˮ�������ڴֻ�ѧ��Ӧ�������ᷢ��
��ˮ�ı�����С��������ά������
������Ӫ�����ʵ������벻��ˮ
A. �٢� B. �ڢ� C. �ڢ� D. �ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼���γɻ�������������Ԫ�أ��䵥�ʼ������������������������Ҫ��Դ��������ش��������⣺
(1)�л���M����̫������տ�ת����N��ת���������£�
 ��H=+88.6kJ/mol
��H=+88.6kJ/mol
��M��N��ȣ����ȶ�����____��
(2)��֪CH3OH����ȼ����Ϊ726.5kJ��mol-1��CH3OH(l) + l/2O2(g)=CO2(g)+2H2(g)
��H=-akJ��mol-1����a_______726.5 (����>������<���� ��=����
(3)��Cl2��H2O(g)ͨ�����ȵ�ľ̿�㣬����HCl��CO2������1mol Cl2���뷴Ӧʱ�ͷų�145 kJ������д���÷�Ӧ���Ȼ�ѧ����ʽ��______________________ ��
(4)����͵�������ı������������ʡ���ʯī�����ۺͶ������Ѱ�һ����������ڸ��������գ��������ʿ������²��ϣ� 4Al(s)+3TiO2(s)+3C(s)=2Al2O3(s)+3TiC(s) ��H=-1176kJ��mol-1����27g������ȫ��Ӧ�ų�������Ϊ_____________��
(5)��֪��Fe2O3(s)+3C(ʯī)=2Fe(s)+3CO(g) ��H=+489.0 kJ mol-1
CO(g)+l/2O2(g)=CO2(g) ��H=-283. 0kJ mol-1
C (ʯī)+O2(g)=CO2(g) ��H=-393.5kJ mol-1
��4Fe (s)+3O2(g) =2Fe2O3 (s) ��H=____________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com