
【题目】碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质。请回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程如下:
 △H=+88.6kJ/mol
△H=+88.6kJ/mol
则M与N相比,较稳定的是____。
(2)已知CH3OH⑴的燃烧热为726.5kJ·mol-1,CH3OH(l) + l/2O2(g)=CO2(g)+2H2(g)
△H=-akJ·mol-1,则a_______726.5 (填“>”、“<”或 “=”)
(3)将Cl2和H2O(g)通过灼热的木炭层,生成HCl和CO2。当有1mol Cl2参与反应时释放出145 kJ热量,写出该反应的热化学方程式:______________________ 。
(4)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料, 4Al(s)+3TiO2(s)+3C(s)=2Al2O3(s)+3TiC(s) △H=-1176kJ·mol-1,则27g铝粉完全反应放出的热量为_____________。
(5)已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) △H=+489.0 kJ mol-1
CO(g)+l/2O2(g)=CO2(g) △H=-283. 0kJ mol-1
C (石墨)+O2(g)=CO2(g) △H=-393.5kJ mol-1
则4Fe (s)+3O2(g) =2Fe2O3 (s) △H=____________。
【答案】 M < 2Cl2(g)+2H2O(g)+C(s)=4HCl(g)+CO2(g) △H=-290kJ mol-1 294kJ -1641.0 kJ mol-1
【解析】试题分析:本题考查反应热的计算,热化学方程式的书写,反应热与物质稳定性的关系。
(1)M转化成N为吸热反应,则1molM具有的总能量低于1molN具有的总能量,M较稳定。
(2)CH3OH(l)的燃烧热为726.5kJ·mol-1,CH3OH(l)燃烧热表示的热化学方程式为:CH3OH(l) + 3/2O2(g)=CO2(g)+2H2O(l) △H=-726.5kJ·mol-1,H2燃烧生成H2O(l)放热,则a![]() 726.5。
726.5。
(3)根据题意写出方程式2Cl2(g)+2H2O(g)+C(s)=4HCl(g)+CO2(g),有1mol Cl2参与反应时释放出145 kJ热量,则2 mol Cl2参与反应时释放出290 kJ热量,反应的热化学方程式为2Cl2(g)+2H2O(g)+C(s)=4HCl(g)+CO2(g) △H=-290kJ mol-1。
(4)根据热化学方程式知4molAl完全反应释放1176kJ的热量,27gAl即1molAl完全反应释放的热量为1176kJ/4=294kJ。
(5)对三个反应编号:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) △H=+489.0 kJ mol-1(①)
CO(g)+l/2O2(g)=CO2(g) △H=-283. 0kJ mol-1(②)
C (石墨)+O2(g)=CO2(g) △H=-393.5kJ mol-1(③)
运用盖斯定律,③![]() 6-②
6-②![]() 6-①
6-①![]() 得,4Fe (s)+3O2(g) =2Fe2O3 (s) △H=(-393.5kJ mol-1)
得,4Fe (s)+3O2(g) =2Fe2O3 (s) △H=(-393.5kJ mol-1)![]() 6-(-283. 0kJ mol-1)
6-(-283. 0kJ mol-1)![]() 6-(+489.0 kJ mol-1)
6-(+489.0 kJ mol-1)![]() 2=-1641.0 kJ mol-1,反应4Fe (s)+3O2(g) =2Fe2O3 (s)的ΔH=-1641.0 kJ mol-1。
2=-1641.0 kJ mol-1,反应4Fe (s)+3O2(g) =2Fe2O3 (s)的ΔH=-1641.0 kJ mol-1。


科目:高中化学 来源: 题型:
【题目】一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(s)。2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2mol/L。下列判断正确的是
xC(g)+2D(s)。2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2mol/L。下列判断正确的是
A. 从开始到平衡A的平均反应速率为0.3mol/(L![]() s)
s)
B. 从开始到平衡B的转化率为60%
C. 此反应的化学平衡常数表达式![]()
D. 若混合气体的密度不再改变时,该反应一定达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅孔雀石是一种含铜的矿石,含铜形态为 CuCO3·Cu(OH)2 和 CuSiO3·2H2O,同时含有SiO2、FeCO3、Fe2O3、Al2O3等杂质。以硅孔雀石为原料制取硫酸铜的工艺流程如图所示:
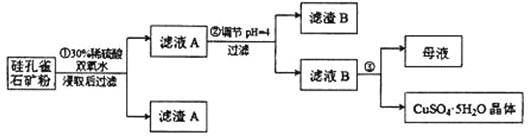
请回答下列问题;
(1)步骤①过滤所需的玻璃仪器包括烧杯、______________________。
(2)写出步骤①中在矿粉中加入30%稀硫酸时,CuSiO3·2H2O 发生反应的方程式:_______________________________________。
(3)步骤①中加入双氧水的作用是_____________________________(用离子方程式表示)
(4)步骤②中调节溶液的pH约为4,可以达到除去Fe3+而不损失CuSO4的目的,调节溶液pH可以选用的最佳试剂是_____________
A.Cu(OH)2 B.NH3·H2O C.CuO D.NaOH
(5)有关氢氧化物开始沉淀和完全沉淀的pH如下表:
氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 |
步骤②中,调节pH时,所得滤渣B的成分的化学式为______________
(6)步骤③将滤液B通过加热浓缩、__________、过滤等操作可得到硫酸铜晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。已知C2H4和C3H6的混合物的质量为14g,有关该混合物的说法错误的是( )
A.燃烧时消耗的氧气为33.6LB.所含碳原子数目为NA
C.所含电子数目为8NAD.所含碳氢键数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现代以石油化工为基础的三大合成材料是
①合成氨②塑料 ③医药 ④合成橡胶 ⑤合成尿素 ⑥合成纤维⑦合成洗涤剂
A.②④⑦ B.②④⑥ C.①③⑤ D.④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图两瓶体积相等的气体,在同温、同压时瓶内气体的关系一定正确的是( ) 
A.所含原子数相等
B.所含分子数相等
C.气体质量相等
D.所含C原子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要配制0.50mol/L NaCl溶液480mL.按下列操作步骤填上适当的文字,以使整个操作完整.
(1)选择仪器.完成本实验所必需的仪器有:托盘天平(精确到0.1g)、药匙、烧杯、玻璃棒、、以及等质量的两片滤纸.
(2)计算.配制该溶液需取NaCl晶体g.
(3)称量.①天平调平之后,应将天平的游码调至某个位置,请在图1中用一根竖线标出游码左边缘所处的位置: 
②称量过程中NaCl晶体应放于天平的(填“左盘”或“右盘”).
③称量完毕,将药品倒入烧杯中.
(4)溶解、冷却,该步实验中需要使用玻璃棒,目的是 .
(5)转移、洗涤.在转移时应使用引流,需要洗涤烧杯2~3次是为了 .
(6)定容,摇匀. 将配好的溶液静置一段时间后,倒入指定的试剂瓶,并贴好标签,注明配制的时间、、 .
(7)在配制过程中,某学生观察定容时液面情况如图2所示,所配溶液的浓度会(填“偏高”、“偏低”或“无影响”).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com