
����Ŀ��������BN����һ����Ҫ�Ĺ����մɲ��ϣ���ش��������⣺
��1����̬Bԭ�ӵĵ����Ų�ʽΪ___________��B��N��ȣ��縺�Խϴ����_________��
��2����BF3�����У� Bԭ�ӵ��ӻ��������Ϊ___________�� BF3���ӵĿռ乹��Ϊ_____________��
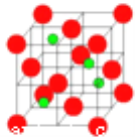
��3�������������ڸ��¸�ѹ�£�����ת��Ϊ��������������ṹ����ʯ���ƣ� Ӳ������ʯ�൱�������߳�Ϊ361.5pm�������������к���__________����ԭ�ӡ�������������ܶ���___________g��cm-3��ֻҪ������ʽ�����ؼ������ֵ������٤������ΪNA����
���𰸡���1����1��1s22s22p1��2�֣� N ��2�֣�
��2�� sp2�� ƽ�������� ����1�֣���2�֣�
��3�� 4��1�֣� ![]() ����2�֣�
����2�֣�
��������
�����������1��Bԭ�Ӻ�����5�����ӣ����ݹ���ԭ����д���̬ԭ�Ӻ�������Ų�ʽΪ1s22s22p1��ͬ����Ԫ�أ��縺������ԭ������������������Ե縺��N��B��
��2�����ݼ۲���ӶԻ�������ȷ��ԭ���ӻ���ʽ�����ռ乹�ͣ�BF3������Bԭ�Ӽ۲���ӶԸ�����3�Ҳ����µ��Ӷԣ�����BF3������B����sp2�ӻ������ӹ���Ϊƽ�������Ρ�
��3���þ��������Bԭ��λ�ڶ���������ϣ���Nԭ��λ�ھ����ڲ�����һ�����������������Bԭ������һ��Nԭ�ӣ����Ըþ�����Bԭ�Ӹ���=8��1/8+6��1/2=4��Nԭ�Ӹ���Ϊ4���þ����߳�=361.5pm=361.5��10-10cm�����=��361.5��10-10cm��3���ܶ�=��M/NA��4����V=![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���������õ������������з�����ȡ�ģ�
4HCl(Ũ)��MnO2![]() Cl2����MnCl2��2H2O
Cl2����MnCl2��2H2O
һ��ʵ���У��ù�����Ũ����(���ܶ�Ϊ1.19 g��mL��1��HCl����������Ϊ36.5%)��һ������MnO2��Ӧ��MnO2��ȫ�ܽ⣬������5.6 L(��״����)���������Լ��㣺
(1)Ũ��������ʵ���Ũ�ȡ�
(2)��������HCl�����ʵ�����
(3)MnO2��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС�����÷Ͼɸɵ�ػ���ԭ���еĶ������̺��Ȼ�李����������ϣ��Ͼɸɵ�ص����ϵ���Ҫ�ɷ�Ϊ�������̡�̼�ۡ��Ȼ�李��Ȼ�п�ȣ������Ȼ�李��Ȼ�п������ˮ����ȤС��ͬѧ�ǣ���ƻ������ʵ���������ͼ��ʾ��
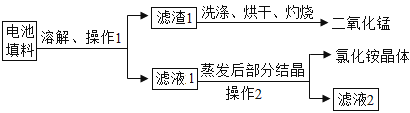
��1������1 �Ͳ���2 �����ƶ���_________���ò����в�������������________��
��2����������l ��Ŀ����_________��
��3����֪��Һl���Ȼ������Ȼ�п��Ũ���������ij�¶���������Һ1ʱ���������Ȼ�Ǯ������������˵�����¶����Ȼ�Ǯ�ܽ��______________�Ȼ�п���ܽ��(����<������ =������>�� )
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й�ú�������У�����ȷ���� �� ��
A��ú�ǹ�ҵ�ϻ�ñ����ױ������ױ��ȷ���������Ҫ��Դ
B��ú���ɶ����л���������ɵĻ����ں�ú���͵ȳɷ�
C��ú���˺���C��HԪ���⣬������������N��S��O��Ԫ��
D��ú�Ȼ�ʯȼ�ϵĴ������ޣ����ܺͿ�������Դ������ʵ�ֿɳ�����չ�Ĺؼ�֮һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�У����������ٶ������ǣ� ��
A������������6mol/L������
B��������þ��3mol/L�Ĵ���
C������������3mol/L������
D��������þ��3mol/L������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ij��ѧ��Ӧ����ģ��ʾ��ͼ������˵����ȷ����()

A���÷�Ӧ�����û���Ӧ B����Ӧǰ��ԭ������䡢��Ŀ�ı�
C����Ӧ���а������ֻ����� D��������Ӧ�ķ��Ӹ�����Ϊ1:1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Һ�е����ӷ�Ӧ������˵�������в���ȷ����
�ٲ�������������ԭ��Ӧ ��ֻ���Ǹ��ֽⷴӦ ���п������û���Ӧ �ܲ������з��Ӳμ�
A. �٢ڢ� B. �� C. �ڢ� D. �٢ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ͬϵ����� ����Ϊͬ���칹����� ����Ϊͬ����������� ��ͬ��ͬλ�ص��� ����ͬһ�����ʵ��� ��
��1��Һ��
��2��![]()
��3������
��4������
��5��2��2����������
��6����ˮ
��7��![]()
��8��![]()
��9��![]() Cl
Cl
��10������
��11��![]() Cl��
Cl��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij������Ʒ�к��������Ȼ������ʣ�������ͼ��ʾװ�����ⶨ�ô�����Ʒ�Ĵ��ȡ�ʵ�鲽�����£�
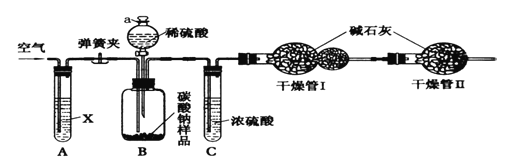
����ͼ��������װ�ò���������ԣ���ȷ����ʢ�м�ʯ�ң������������ƺ���ʯ�ҵĻ����ĸ����������������Ϊm1������ȷ����������Ʒ����������Ϊn����������ƿB�ڣ�����Һ©��a����������������ϡ���ᣬ�����ٲ�������Ϊֹ�������Թ�A����������������ӣ�Ȼ����������������������Ϊm2�����Իش�
��1��ʵ�������������Ҫ�����ĵؽ��У���������_____________���������������̫�죬�ᵼ�²ⶨ���________����ƫ��ƫС�䣩��
��2�����������Ŀ����______________��װ��A�е��Լ�XӦѡ��________________����������__________________��
��3��װ��C��������___________________�����������������__________________��
��4��װ��A��B֮��ĵ��ɼ��ڵ�_________�����ǰ������ڵ�_________�����������ǰ����н���
��5�����ݴ�ʵ�飬д�����㴿����Ʒ���ȵĹ�ʽ��___________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com