
【题目】实验室中所用的氯气是用下列方法制取的:
4HCl(浓)+MnO2![]() Cl2↑+MnCl2+2H2O
Cl2↑+MnCl2+2H2O
一次实验中,用过量的浓盐酸(其密度为1.19 g·mL-1、HCl的质量分数为36.5%)跟一定量的MnO2反应,MnO2完全溶解,产生了5.6 L(标准状况下)的氯气。试计算:
(1)浓盐酸的物质的量浓度。
(2)被氧化的HCl的物质的量。
(3)MnO2的质量。
科目:高中化学 来源: 题型:
【题目】中和反应是放热反应。取10 mL溶质质量分数为10%的NaOH溶液(密度1.10g/ml)置于烧杯中(并滴入2滴酚酞),向烧杯中逐滴加入稀盐酸。随着盐酸的滴入,烧杯中溶液颜色从红色逐渐变浅,当加入10 mL稀盐酸时,溶液恰好变为无色。烧杯中溶液温度与加入盐酸体积之间关系如图所示。
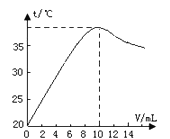
(1)当加入4ml稀盐酸时,烧杯中溶液的溶质为 (写化学式)
(2)试解释烧杯中溶液温度随加入盐酸的体积发生变化的原因 。
(3)当盐酸与氢氧化钠恰好中和时生成氯化钠多少克?(精确到0.1g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(15分)某学生研究小组欲探究CuSO4溶液与Na2CO3溶液混合产生的蓝绿色沉淀组成,小组进行下列实验探究。
【提出假设】
假设1:沉淀为Cu(OH)2;假设2:所得沉淀为_____________;
假设3:所得沉淀为碱式碳酸铜[化学式可表示为nCu(OH)2·mCuCO3]。
【查阅资料】无论是哪一种沉淀受热均易分解(假设均不含结晶水)。
【物质成分探究】
步骤1:将所得悬浊液过滤,用蒸馏水洗涤,再用无水乙醇洗涤;
步骤2:甲同学取一定量所得固体,用气密性良好的如图装置(夹持仪器未画出)进行定性实验。
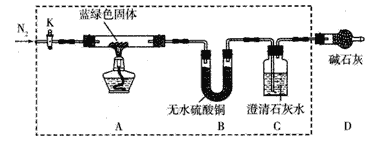
请回答下列问题:
(1)假设2中的沉淀是为______________。
(2)假设1中沉淀为Cu(OH)2的理论依据是_________________。
(3)无水乙醇洗涤的目的__________________。
(4)若反应后A中蓝绿色固体变黑,C中无明显现象,证明假设________________(填写序号)成立。
(5)乙同学认为只要将上图中B装置的试剂改用_______________试剂后,便可验证上述所有假设。
(6)乙同学更换B试剂后验证假设3成立的实验现象是___________________。
(7)在假设3成立的前提下,某同学考虑用Ba(OH)2代替Ca(OH)2,测定蓝绿色固体的化学式,若所取蓝绿色固体质量为27.1g,实验结束后装置B的质量增加2.7g,C中的产生沉淀的质量为19.7g。则该蓝绿色固体的化学式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的应用正确的是
A. 金属钠着火可用泡沫灭火器扑灭
B. 烘焙食品时加入小苏打可以使食品蓬松
C. 氧化亚铁俗称铁红,常用作油漆涂料
D. 用氧化铝制成的坩埚可用于加热苛性钠固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质结构的说法正确的是( )
A. 电子层数多的原子的半径一定大于电子层数少的原子的半径
B. P4S3分子中各原子的最外层均已达到了8电子稳定结构,则分子中共价键数目为9条
C. H2SO3酸性强于H2CO3,所以非金属性S大于C
D. 不同原子形成的化合物中一定只含极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅的冶炼大致过程如下:
①富集:将方铅矿(PbS)进行浮选;
②焙烧:2PbS+3O2![]() 2PbO+2SO2;
2PbO+2SO2;
③制粗铅:PbO+C![]() Pb+CO↑;PbO+CO
Pb+CO↑;PbO+CO![]() Pb+CO2。
Pb+CO2。
下列说法正确的是( )
A.浮选法富集方铅矿的过程属于化学变化
B.方铅矿焙烧反应中,PbS是还原剂,还原产物只有PbO
C.整个冶炼过程中,制取1 mol Pb共转移2 mol电子
D.将1 mol PbS完全冶炼成Pb理论上至少需要6 g碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅是一种重要的半导体材料,应用范围广,三氯苯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程如图所示:
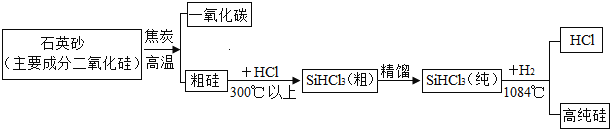
(1)硅属于_______(填“金属”或“非金属”)元素;
(2)上述流程中最后一步反应的化学方程式为____________。
(3)如果还原SiHCl3过程中混入O2,可能引起的后果是___________。
(4)该流程中可以循环利用的物质的化学式是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硼(BN)是一种重要的功能陶瓷材料,请回答下列问题:
(1)基态B原子的电子排布式为___________;B和N相比,电负性较大的是_________;
(2)在BF3分子中, B原子的杂化轨道类型为___________; BF3分子的空间构型为_____________;
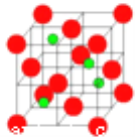
(3)六方氮化硼在高温高压下,可以转化为立方氮化硼晶胞,其结构与金刚石相似, 硬度与金刚石相当,晶胞边长为361.5pm,立方氮化硼晶胞中含有__________个氮原子、立方氮化硼的密度是___________g·cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com