
【题目】中和反应是放热反应。取10 mL溶质质量分数为10%的NaOH溶液(密度1.10g/ml)置于烧杯中(并滴入2滴酚酞),向烧杯中逐滴加入稀盐酸。随着盐酸的滴入,烧杯中溶液颜色从红色逐渐变浅,当加入10 mL稀盐酸时,溶液恰好变为无色。烧杯中溶液温度与加入盐酸体积之间关系如图所示。
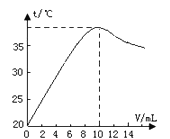
(1)当加入4ml稀盐酸时,烧杯中溶液的溶质为 (写化学式)
(2)试解释烧杯中溶液温度随加入盐酸的体积发生变化的原因 。
(3)当盐酸与氢氧化钠恰好中和时生成氯化钠多少克?(精确到0.1g)
【答案】(1)NaOH NaCl
(2)中和反应放热,随着反应的进行,放出热量增加,溶液温度逐渐升高,加入10毫升稀盐酸时恰好完全反应,溶液温度最高。继续加入盐酸后,溶液被稀释冷却,温度逐渐下降。
(3)1.6g
【解析】
试题分析:(1)向氢氧化钠溶液中滴入稀盐酸,两者发生反应生成氯化钠和水,当加入4mL时,根据图像反应温度没有达到最高,说明NaOH有剩余,则烧杯中溶液的溶质为NaOH和NaCl。
(2)中和反应放热,随着反应的进行,放出热量增加,溶液温度逐渐升高,加入10毫升稀盐酸时恰好完全反应,溶液温度最高。继续加入盐酸后,溶液被稀释冷却,温度逐渐下降,所以温度先升高后降低。
(3)解:设生成氯化钠的质量为x
NaOH + HCl = NaCl + H2O
40 58.5
1.1mL×1.1g/mL×10% x
40/( 1.1mL×1.1g/mL×10%)=58.5/x,解得x=1.6g
答:生成氯化钠的质量为1.6g。


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案科目:高中化学 来源: 题型:
【题目】某溶液中含有Ba2+、Cu2+、Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离。其流程图如图,则

(1)沉淀的化学式:沉淀1________,沉淀2________,沉淀3___ ____。
(2)写出混合液+A的离子方程式________________;溶液+B的离子方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
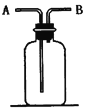
(1)洗气:除去CO中的水蒸气,装置内应盛放 ;
(2)检验:证明CO中混有CO2,装置内应盛放 ;
(3)集气:若用排空气法收集比空气轻的气体时,气体应从装置的 端通入(填“A” 或“B”,下同);若收集比空气重的气体,则气体从 端通入。若用排水法收集O2时,瓶内应先装满水,气体从 端通入。
(4)贮气:若要用水将装置中的氧气排出进行实验时,水应从 端通入。
(5)量气:若要测定实验室制得的少量O2的体积,则应在瓶内先装满水,再将O2从 端通入。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,氧化剂与还原剂物质的量的关系为1:2的是
A. 4KI+O2+2H2O=4KOH+2I2
B. 2CH3COOH+Ca(ClO)2=2HClO+(CH3COO)2Ca
C. I2+2NaClO3=2NaIO3+Cl2
D. MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中所用的氯气是用下列方法制取的:
4HCl(浓)+MnO2![]() Cl2↑+MnCl2+2H2O
Cl2↑+MnCl2+2H2O
一次实验中,用过量的浓盐酸(其密度为1.19 g·mL-1、HCl的质量分数为36.5%)跟一定量的MnO2反应,MnO2完全溶解,产生了5.6 L(标准状况下)的氯气。试计算:
(1)浓盐酸的物质的量浓度。
(2)被氧化的HCl的物质的量。
(3)MnO2的质量。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com