
【题目】下列元素中气态电中性基态原子的第一电离能最小的是( )
A.B
B.C
C.N
D.O
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏伽德罗常数的值,下列叙述正确的是( )
A.标准状况下,18gH218O所含质子数为10NA
B.1 mol乙醇中含有极性键的数目为8NA
C.1mol的﹣NH2与1molNH4+所含电子数均为10NA
D.1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列说法不正确的是
A. 次氯酸钠溶液可用作环境的杀菌消毒
B. 硅胶可用作商品包装袋的干燥剂
C. 爆竹燃放后,硫燃烧生成SO3
D. 施肥时,草木灰不能与胺态氮肥混合使用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在电解冶炼铝的过程中加入冰晶石,可起到降低Al2O3熔点的作用。冰晶石的生产原理为2Al(OH)3+12HF+3Na2CO3===2Na3AlF6+3CO2↑+9H2O。根据题意完成下列填空:
(1) (3分)冰晶石的晶体不导电,但熔融时能导电,则在冰晶石晶体中存在________(填序号)。
a.离子键 b.极性键 c.配位键 d.范德华力
(2) (3分)CO2分子的空间构型为____________,中心原子的杂化方式为____________,和CO2 互为等电子体的氧化物是________。
(3) (2分)反应物中电负性最大的元素为_______(填元素符号),写出其原子最外层的电子排布图:____________。
(4) (2分)冰晶石由两种微粒构成,冰晶石的晶胞结构如图Z164甲所示,●位于大立方体的顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处所代表的微粒是________(填具体的微粒符号)。
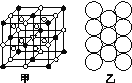
图Z164
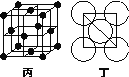
(5) (5分)Al单质的晶体中原子的堆积方式如图乙所示,其晶胞特征如图丙所示,原子之间相互位置关系的平面图如图丁所示:
若已知Al的原子半径为d,NA代表阿伏伽德罗常数,Al的相对原子质量为M,则一个晶胞中Al原子的数目为________个;Al晶体的密度为______________________(用字母表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中和反应是放热反应。取10 mL溶质质量分数为10%的NaOH溶液(密度1.10g/ml)置于烧杯中(并滴入2滴酚酞),向烧杯中逐滴加入稀盐酸。随着盐酸的滴入,烧杯中溶液颜色从红色逐渐变浅,当加入10 mL稀盐酸时,溶液恰好变为无色。烧杯中溶液温度与加入盐酸体积之间关系如图所示。
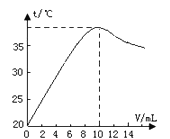
(1)当加入4ml稀盐酸时,烧杯中溶液的溶质为 (写化学式)
(2)试解释烧杯中溶液温度随加入盐酸的体积发生变化的原因 。
(3)当盐酸与氢氧化钠恰好中和时生成氯化钠多少克?(精确到0.1g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.3p2表示3p能级有两个轨道
B.同一原子中,1s、2s、3s电子能量逐渐减小
C.处于最低能量的原子叫做基态原子
D.同一原子中,2p、3p、4p能级的轨道数依次增多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下:
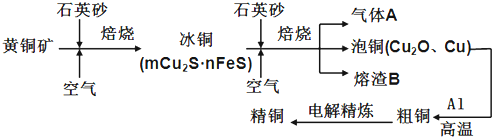
(1)气体A中的大气污染物可选用下列试剂中的 吸收.
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨水
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在 (填离子符号),检验溶液中还存在Fe2+的方法是
(3)由泡铜冶炼粗铜的化学反应方程式为 .
(4)取一定量的泡铜,加入1L0.6mol/LHNO3溶液恰好完全溶解,同时放出2240mLNO气体(标准状况),另取等量的泡铜,用足量的H2还原,得到的铜的质量为 g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质结构的说法正确的是( )
A. 电子层数多的原子的半径一定大于电子层数少的原子的半径
B. P4S3分子中各原子的最外层均已达到了8电子稳定结构,则分子中共价键数目为9条
C. H2SO3酸性强于H2CO3,所以非金属性S大于C
D. 不同原子形成的化合物中一定只含极性键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com