
【题目】下列有关物质结构的说法正确的是( )
A. 电子层数多的原子的半径一定大于电子层数少的原子的半径
B. P4S3分子中各原子的最外层均已达到了8电子稳定结构,则分子中共价键数目为9条
C. H2SO3酸性强于H2CO3,所以非金属性S大于C
D. 不同原子形成的化合物中一定只含极性键
【答案】B
【解析】试题分析:A.同主族从上到下电子层数增多,原子半径增大,不是同主族电子层多半径不一定大;
B.P的最外层有5个电子,形成3个单键可达8电子稳定结构,S的最外层为6个电子,形成2个单键可达到8电子稳定结构,然后根据均摊法计算出P4S3分子中含有的共价键数目;
C.利用最高价含氧酸的酸性比较非金属性;
D.不同原子形成的共价键可能含非极性键.
解:A.同主族从上到下电子层数增多,原子半径增大,则同主族电子层数多的原子半径比电子层数少的大,不是同主族电子层多半径不一定大,如Li的半径大于Cl的半径,故A错误;
B.P4S3分子中没有不饱和键,且各原子的最外层均已达到了8个电子的结构,P原子最外层为5个电子,可形成3个共价键,根据均摊法,每个P原子形成的共价键数目为:![]() ×3=
×3=![]() ,4个P原子形成的共价键数目为
,4个P原子形成的共价键数目为![]() ×4=6;S原子最外层6个电子,可形成2个共价键,每个S原子可形成的共价键数目为
×4=6;S原子最外层6个电子,可形成2个共价键,每个S原子可形成的共价键数目为![]() ×2=1,3个S原子形成的共价键数目为:1×3=3,因此一个三硫化四磷分子中含有的共价键个数为6+3=9个,故B正确;
×2=1,3个S原子形成的共价键数目为:1×3=3,因此一个三硫化四磷分子中含有的共价键个数为6+3=9个,故B正确;
C.H2SO3酸性强于H2CO3,不能判断非金属性S大于C,因亚硫酸不是最高价含氧酸,故C错误;
D.不同原子形成的化合物中可能含非极性键,如H﹣O﹣O﹣H中含极性键、非极性键,故D错误;
故选B.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
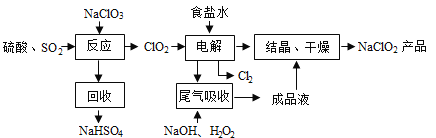
回答下列问题:
(1)“电解”所用食盐水由粗盐水精制而成,精制时为除去Mg2+和Ca2+,要加入的试剂分别
为______、________。
(2)写出“反应”步骤中生成ClO2的化学方程式____________。
(3)实验所用原料硫酸是由浓硫酸稀释而获得,写出实验过程_____________。
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2。此吸收反应中,氧化剂与还原剂的物质
的量之比为_______。
(5)将lmol SO2和lmol Cl2通入水中形成lL的溶液,所得溶液中氢离子浓度为_______mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向甲、乙两个容积均为1L的恒容容器中,分别充入2mol A、2mol B和1mol A、1mol B.相同温度下,发生反应:A(g)+B(g)xC(g);△H<0.测得两容器中c(A)随时间t的变化如图所示.下列说法正确的是( )
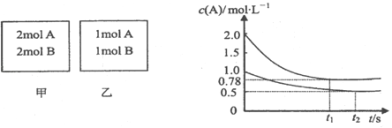
A.x可能等于2
B.甲、乙两容器中反应达平衡时,平衡常数K(甲)<K(乙)
C.将乙容器升温可使甲、乙容器内各物质的体积分数相同
D.若向甲容器中再充入2 mol A、2 mol B,则平衡时甲容器中0.78 molL﹣1<c(A)<1.56 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组探究SO2气体还原Fe3+,他们使用的药品和装置如下图所示。下列说法不合理的是( )
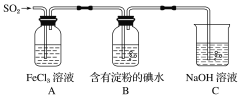
A.能表明I-的还原性弱于SO2的现象是B中蓝色溶液褪色
B.装置C的作用是吸收SO2尾气,防止污染空气
C.为了验证A中发生了氧化还原反应,加入酸性KMnO4溶液,紫红色褪去
D.为了验证A中发生了氧化还原反应,加入用稀盐酸酸化的BaCl2溶液,产生白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中所用的氯气是用下列方法制取的:
4HCl(浓)+MnO2![]() Cl2↑+MnCl2+2H2O
Cl2↑+MnCl2+2H2O
一次实验中,用过量的浓盐酸(其密度为1.19 g·mL-1、HCl的质量分数为36.5%)跟一定量的MnO2反应,MnO2完全溶解,产生了5.6 L(标准状况下)的氯气。试计算:
(1)浓盐酸的物质的量浓度。
(2)被氧化的HCl的物质的量。
(3)MnO2的质量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值.下列判断正确的是( )
A.32克O2和O3组成的混合气体中含有的氧原子数目为2NA
B.常温常压下,22.4 L乙醇含有的分子数目为NA
C.1 mol Na变为Na+时得到的电子数目为NA
D.44克14C16O2含氧原子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,产生氢气速度最快的是( )
A.常温下铝与6mol/L的硝酸
B.常温下镁与3mol/L的醋酸
C.常温下铁与3mol/L的盐酸
D.常温下镁与3mol/L的硫酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com