
| A. | KNO3 | B. | NaCl | C. | Na2CO3 | D. | FeSO4 |
分析 Cu与稀硫酸不反应,硝酸盐在酸性条件下具有硝酸的强氧化性,则可使Cu溶解,同时生成NO气体,据此对各选项进行判断.
解答 解:A.Cu、稀硫酸、KNO3混合时发生3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,则铜粉质量减轻,同时溶液逐渐变为蓝色,且有气体逸出,故A正确;
B.Cu、稀硫酸、NaCl混合时,不会发生反应,故B错误;
C.Cu与稀硫酸不反应,加入Na2CO3时与酸反应生成二氧化碳气体,但Cu不溶解,故C错误;
D.Cu、稀硫酸、FeSO4混合时不发生反应,故D错误;
故选A.
点评 本题考查铜及硝酸盐在酸性条件下的性质,题目难度不大,明确常见物质性质为解答关键,注意硝酸根离子在酸性条件下具有强氧化性,试题培养了学生的分析能力及灵活应用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向明矾溶液中加入过量的氢氧化钡溶液:Al3++2SO42-+2 Ba2++4OH-=AlO2-+2BaSO4↓+2H2O | |
| B. | 向氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+=Fe2++2H2O | |
| C. | 向磷酸二氢铵溶液中加入足量的氢氧化钠溶液:NH4++OH-=NH3•H2O | |
| D. | 向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH-$\stackrel{△}{→}$CH2BrCOO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
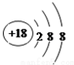
| 反应 | 大气固氮 N2(g)+O2(g)?2NO(g) | 工业固氮 N2(g)+3H2(g)?2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 离子组 | 加入试剂 | 加入试剂后发生反应的离子方程式 |
| A | NH4+、Fe2+、SO42- | 少量Ba(OH)2溶液 | 2NH4++SO42-+Ba2++2OH-=BaSO4↓+2NH3•H2O |
| B | Na+、OH-、Cl- | 少量Mg(HCO3)2溶液 | Mg2++2HCO3-+4OH-=2H2O+Mg(OH)2↓+2CO32- |
| C | K+、NH3•H2O、CO32- | 通入少量CO2 | 2OH-+CO2=CO32-+H2O |
| D | Fe2+、NO3-、HSO3- | NaHSO4溶液 | HSO3-+H+=SO2↑+H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 方案 |
| A | 除去乙酸乙酯中的乙酸 | 用NaOH溶液洗涤,分液,然后干燥 |
| B | 制备少量漂白粉 | Cl2通人澄清石灰水中,然后蒸发结晶 |
| C | 检验食盐中是否添加KIO3 | 食盐溶解,然后加入淀粉溶液 |
| D | 测定醋酸溶液浓度 | 酚酞作指示剂,用标准NaOH溶液滴定 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| X | Y | ||
| W | Q |
| A. | 简单离子半径大小关系为:W>Z>Y | |
| B. | 核外最外层电子数:Q>Y>X>W>Z | |
| C. | X与氢元素形成的化合物中,只含极性键 | |
| D. | 常见单质的熔沸点:X>W>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaSO4在医学上用作“钡餐”,Ba2+对人体无害 | |
| B. | 高锰酸钾溶液、酒精、双氧水都能杀菌消毒,消毒原理相同,都利用了强氧化性 | |
| C. | 光导纤维的主要成分是单质硅,太阳能电池使用的材料是SiO2 | |
| D. | “地沟油”禁止食用,但可以用来制肥皂或燃油 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com