
| 选项 | 离子组 | 加入试剂 | 加入试剂后发生反应的离子方程式 |
| A | NH4+、Fe2+、SO42- | 少量Ba(OH)2溶液 | 2NH4++SO42-+Ba2++2OH-=BaSO4↓+2NH3•H2O |
| B | Na+、OH-、Cl- | 少量Mg(HCO3)2溶液 | Mg2++2HCO3-+4OH-=2H2O+Mg(OH)2↓+2CO32- |
| C | K+、NH3•H2O、CO32- | 通入少量CO2 | 2OH-+CO2=CO32-+H2O |
| D | Fe2+、NO3-、HSO3- | NaHSO4溶液 | HSO3-+H+=SO2↑+H2O |
| A. | A | B. | B | C. | C | D. | D |
分析 A.少量Ba(OH)2溶液,铵根离子不反应;
B.少量Mg(HCO3)2溶液完全反应,生成氢氧化镁、碳酸钠和水;
C.通入少量CO2与NH3•H2O反应;
D.离子之间发生氧化还原反应,不能共存.
解答 解:A.少量Ba(OH)2溶液,铵根离子不反应,离子反应为Fe2++SO42-+Ba2++2OH-=BaSO4↓+Fe(OH)2↓,故A错误;
B.少量Mg(HCO3)2溶液完全反应,生成氢氧化镁、碳酸钠和水,离子反应为Mg2++2HCO3-+4OH-=2H2O+Mg(OH)2↓+2CO32-,故B正确;
C.通入少量CO2与NH3•H2O反应,离子反应为2NH3•H2O+CO2=2NH4++CO32-+H2O,故C错误;
D.Fe2+、NO3-、HSO3-发生氧化还原反应,不能共存,故D错误;
故选B.
点评 本题考查离子共存及离子反应方程式书写,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应、氧化还原反应的判断,注重学生思维严密性的训练,题目难度不大.


科目:高中化学 来源: 题型:解答题


 .
.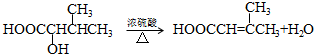 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验操作 | |
| A | 比较金属性:Mg>Al | 往盛同浓度同体积的盐酸的两试管中分别加入Mg条和Al粉 |
| B | 证明Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 | 向2mL 1mol/L NaOH溶液中先加入3滴1mol/L MgCl2溶液,再加入3滴1mol/L FeCl3溶液 |
| C | 比较氧化性:Fe3+>I- | 往滴有CCl4的FeI2溶液中慢慢滴加氯水 |
| D | 配制1.0mol/L的NaOH溶液 | 称取4g NaOH晶体溶于100mL蒸馏水中 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
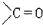 +RMgX→
+RMgX→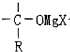 $\stackrel{H_{2}O}{→}$
$\stackrel{H_{2}O}{→}$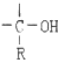
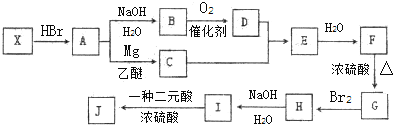
 ,
, .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KNO3 | B. | NaCl | C. | Na2CO3 | D. | FeSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向一定量的Al2(SO4)3溶液中逐滴加入氨水至过量,反应的离子方程式是Al3++4OH-=AlO2-+2H2O | |
| B. | 向一定量的NaHCO3溶液中加入足量的澄清石灰水,产生白色沉淀,反应的离子方程式是 Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O | |
| C. | 向适量某溶液中滴入KSCN溶液,溶液变为红色,则该溶液中一定存在Fe3+而不存在Fe2+ | |
| D. | 高锰酸钾酸化要用硫酸而不能用盐酸,其原因是用盐酸酸化会发生反应:10Cl-+2MnO4-+16H+=5Cl2↑+2Mn2++8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
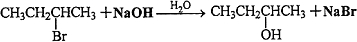
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
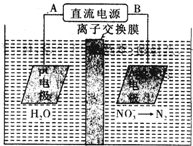
| A. | 电源正极为B | |
| B. | 若电解过程中转移了1mol电子,则膜两侧电解液的质量变化差(|△m左|-|△m右|)为7.2克 | |
| C. | Pt电极上产物为H2 | |
| D. | Ag-Pt电极上发生氧化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com