
| A. | 向一定量的Al2(SO4)3溶液中逐滴加入氨水至过量,反应的离子方程式是Al3++4OH-=AlO2-+2H2O | |
| B. | 向一定量的NaHCO3溶液中加入足量的澄清石灰水,产生白色沉淀,反应的离子方程式是 Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O | |
| C. | 向适量某溶液中滴入KSCN溶液,溶液变为红色,则该溶液中一定存在Fe3+而不存在Fe2+ | |
| D. | 高锰酸钾酸化要用硫酸而不能用盐酸,其原因是用盐酸酸化会发生反应:10Cl-+2MnO4-+16H+=5Cl2↑+2Mn2++8H2O |
分析 A.加入氨水至过量,生成氢氧化铝;
B.加入足量的澄清石灰水,碳酸氢钠完全反应,生成碳酸钙、NaOH和水;
C.滴入KSCN溶液,溶液变为红色,一定含铁离子;
D.发生氧化还原反应,遵循电子、电荷守恒.
解答 解:A.向一定量的Al2(SO4)3溶液中逐滴加入氨水至过量,反应的离子方程式是Al3++3NH3•H2O═3NH4++Al(OH)3↓,故A错误;
B.向一定量的NaHCO3溶液中加入足量的澄清石灰水,产生白色沉淀,反应的离子方程式是Ca2++HCO3-+OH-=CaCO3↓+H2O,故B错误;
C.向适量某溶液中滴入KSCN溶液,溶液变为红色,则该溶液中一定存在Fe3+,不能确定是否存在Fe2+,故C错误;
D.高锰酸钾酸化要用硫酸而不能用盐酸,其原因是用盐酸酸化会发生反应的离子反应为10Cl-+2MnO4-+16H+=5Cl2↑+2Mn2++8H2O,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意复分解反应、氧化还原反应中保留化学式的物质及电子、电荷守恒,注重学生思维严密性的训练,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | CO2、NO2均为酸性氧化物 | B. | 石英、水玻璃均为纯净物 | ||
| C. | NaCl、BaSO4均为强电解质 | D. | 烧碱、纯碱均为碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应 | 大气固氮 N2(g)+O2(g)?2NO(g) | 工业固氮 N2(g)+3H2(g)?2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
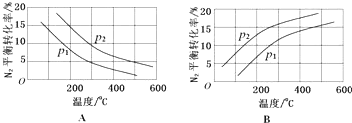
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 离子组 | 加入试剂 | 加入试剂后发生反应的离子方程式 |
| A | NH4+、Fe2+、SO42- | 少量Ba(OH)2溶液 | 2NH4++SO42-+Ba2++2OH-=BaSO4↓+2NH3•H2O |
| B | Na+、OH-、Cl- | 少量Mg(HCO3)2溶液 | Mg2++2HCO3-+4OH-=2H2O+Mg(OH)2↓+2CO32- |
| C | K+、NH3•H2O、CO32- | 通入少量CO2 | 2OH-+CO2=CO32-+H2O |
| D | Fe2+、NO3-、HSO3- | NaHSO4溶液 | HSO3-+H+=SO2↑+H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 方案 |
| A | 除去乙酸乙酯中的乙酸 | 用NaOH溶液洗涤,分液,然后干燥 |
| B | 制备少量漂白粉 | Cl2通人澄清石灰水中,然后蒸发结晶 |
| C | 检验食盐中是否添加KIO3 | 食盐溶解,然后加入淀粉溶液 |
| D | 测定醋酸溶液浓度 | 酚酞作指示剂,用标准NaOH溶液滴定 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/℃ | 2 355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| X | Y | ||
| W | Q |
| A. | 简单离子半径大小关系为:W>Z>Y | |
| B. | 核外最外层电子数:Q>Y>X>W>Z | |
| C. | X与氢元素形成的化合物中,只含极性键 | |
| D. | 常见单质的熔沸点:X>W>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:X>Y>Z | B. | 氧化物的熔点:Z>X | ||
| C. | 简单氢化物稳定性:Z>Y | D. | X、Y、Z单质的晶体类型可能有三种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 宇宙星体、地球内部都处于高压状态,探究“高压下钠和锂单质金属→绝缘体转变”现象的本质、理解处于高压状态下一些物质的行为具有重要意义,它们可以为研究星体和地球内部构造提供理论支持 | |
| B. | 工业、农业以及日常生活中产生的污水应当分开处理.常用的污水处理方法有中和法、氧化还原法、离子交换法、萃取法、吹脱法、吸附法、电渗析法等,其中前三种属于化学处理方法 | |
| C. | 新型炸药--C4塑胶炸药得名于其空间网状延展结构的每个结构基元含有4个碳原子,由于该炸药成体时无需包裹金属外壳及添加金属芯件,因此能轻易躲过普通X光安全检查,具有较强的隐蔽性 | |
| D. | 建筑领域常使用的黏土、石英、白垩石和多用于农业和食品工业的硅藻土、硅胶均不属于硅酸盐材料的范畴 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com