
【题目】能源、资源问题是当前人类社会面临的一项重大课题。
(1) 直接利用物质燃烧提供热能在当今社会仍然占很大比重,但存在利用率低的问题。CH4、CO、CH3OH都是重要的能源物质,等质量的上述气体充分燃烧,消耗O2最多的是_______ (填化学式)。
(2) 燃料电池将能量转化效率比直接燃烧效率高,如图为某种燃料电池的工作原理示意图,a、b均为惰性电极。
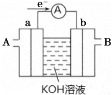
①使用时,空气从_________ 口通入(填“A”或“B”);
②假设使用的“燃料”是甲烷,a极的电极反应为:_________________ 。
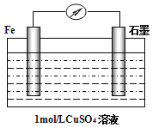
(3)某同学设计如图的原电池,则正极的电极反应式为:______________ ,当导线中有3.01×1023个电子流过,溶液质量变化为________ g。
【答案】CH4 B CH4 - 8e- + 10OH- = CO32- + 7H2O Cu2+ + 2e- = Cu 2
【解析】
(1)CH4、CO、CH3OH燃烧的方程式分别是:CH4+2O2![]() CO2+2H2O、2CO+O2
CO2+2H2O、2CO+O2![]() 2CO2、2CH3OH+3O2
2CO2、2CH3OH+3O2![]() 2CO2+4H2O,根据方程式,每克燃料所对应O2的质量分别是4g、0.57g、1.5g,故相同质量下甲烷消耗氧气最多;
2CO2+4H2O,根据方程式,每克燃料所对应O2的质量分别是4g、0.57g、1.5g,故相同质量下甲烷消耗氧气最多;
(2)①根据图中电子流向可判断a为负极,b为正极,燃料电池中正极需通入O2,故空气从B口通入;
②CH4在负极发生氧化反应,碱性环境中生成CO32-,故电极反应为:CH4 - 8e- + 10OH- = CO32- + 7H2O;
(3)由图可知,Fe为负极,石墨为正极,电解质为CuSO4,正极是Cu2+发生反应:Cu2++2e- = Cu,当导线中有3.01×1023个电子流过,即转移0.5mol电子,溶液中Cu2+转化为Cu析出64g/mol×0.25mol=16g,Fe转化为Fe2+进入溶液质量为56g/mol![]() 0.25mol=14g,故溶液质量减少16g-14g=2g。
0.25mol=14g,故溶液质量减少16g-14g=2g。


科目:高中化学 来源: 题型:
【题目】已知下列数据:
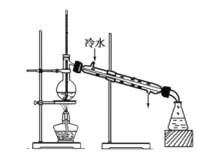
某学生在实验室制取乙酸乙酯的主要步骤如下:
①配制2 mL浓硫酸、3 mL乙醇和2 mL乙酸的混合溶液。
②按图连接好装置(装置气密性良好)并加入混合液,用小火均匀加热3~5 min。
③待试管乙收集到一定量产物后停止加热,撤出试管乙并用力振荡,然后静置待分层。
④分离出乙酸乙酯,洗涤、干燥、蒸馏。最后得到纯净的乙酸乙酯。
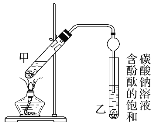
(1)反应中浓硫酸的作用是_________。
(2)写出制取乙酸乙酯的化学方程式:_________。
(3)上述实验中饱和碳酸钠溶液的作用是________。
(4)步骤②为防止加热过程中液体爆沸,该采取什么措施__________。
(5)欲将乙试管中的物质分离以得到乙酸乙酯,必须使用玻璃的仪器有____;分离时,乙酸乙酯应从仪器_____(填“下口放”或“上口倒”)出。
(6)通过分离后饱和碳酸钠中有一定量的乙醇,拟用图回收乙醇,回收过程中应控制温度是_____;找出图中的错误_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ba(AlO2)2可溶于水。右图表示的是向A12(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加人Ba(OH)2的物质的量x的关系。下列有关叙述正确的是 ( )
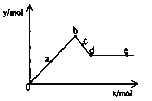
A. a—b时沉淀的物质的量:A1(OH)3比BaSO4多
B. c—d时溶液中离子的物质的量:AlO2–比Ba2+多
C. a—d时沉淀的物质的量:BaSO4可能小于A1(OH)3
D. d—e时溶液中离子的物质的量:Ba2+不能等于OH–
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在分液漏斗中用一种有机溶剂提取水溶液里的某物质时,静置分层后,如果不知道哪一层液体是“水层”,试设计一种简便的判断方法。答:____________________________。
(2)下列操作会使配制的KOH溶液的物质的量浓度偏大的是_______
A、转移溶液后未洗涤烧杯和玻璃棒就直接定容
B、转移溶液过程中有液体溅出容量瓶
C、定容时俯视刻度线
D、配制溶液定容摇匀后发现容量瓶中液面低于刻度线,又补足了水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)2AB(l)的能量变化如图所示,判断下列叙述中正确的是
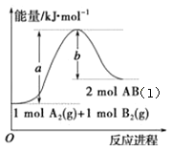
A.每生成2mol气态AB吸收b kJ热量
B.向密闭容器中充入1mol A2和1mol B2充分反应,吸收的热量为(a-b)kJ
C.向密闭容器中充入一定量的A2和B2,生成2mol AB(g),吸收的热量小于(a-b)kJ
D.AB(l)分解为A2(g)和B2(g)的反应为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是某工厂的生产流程:
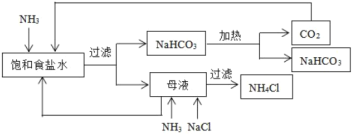
下列分析正确的是( )
A.母液中只含有:NH3和CO2B.母液中只含有:NH4+和Cl-
C.向母液中通NH3、加NaCl时加热D.该工厂的产品是纯碱和NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数的递增,八种短周期元素的原子半径的相对大小、最高正价或最低负价的变化如下图所示,下列分析正确的是( )
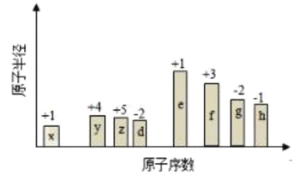
A.![]() 、
、![]() 的简单离子半径大小:
的简单离子半径大小:![]()
B.元素的金属性:![]()
C.元素的非金属性:![]()
D.![]() 、
、![]() 、
、![]() 和
和![]() 四种元素能形成离子化合物
四种元素能形成离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L密闭容器内,800 ℃时反应2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表
2NO2(g)体系中,n(NO)随时间的变化如表
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)下图表示NO2的变化的曲线是________。用O2表示从0~2 s内该反应的平均速率v=________。
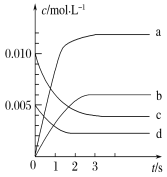
(2)能说明该反应已达到平衡状态的是________(填字母,下同)。
a. v(NO2)、v(O2)、v(NO)相等
b. 容器内各物质浓度保持不变
c. 该反应v逆=v正
d. 容器内总质量保持不变
(3)为使该反应的反应速率增大,下列措施正确的是________。
a 及时分离出NO2气体 b 适当升高温度
c 增大O2的浓度 d 选择高效催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.一定温度下,在容积为V L的密闭容器中进行反应:aN(g)![]() bM(g),M、N的物质的量随时间的变化曲线如图所示:
bM(g),M、N的物质的量随时间的变化曲线如图所示:

(1)此反应的化学方程式中a/b=___________;
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为_________________;
(3) N的平衡转化率为_______________;
(4)下列叙述中能说明上述反应达到平衡状态的是___________(填字母)。
a.反应中M与N的物质的量之比为1︰1
b.混合气体的总质量不随时间的变化而变化
c.混合气体的总物质的量不随时间的变化而变化
d.单位时间内每消耗a mol N,同时生成b mol M
e.混合气体的压强不随时间的变化而变化
f.N的质量分数在混合气体中保持不变
Ⅱ.研究性学习小组为探究铁与稀盐酸反应,取同质量、体积的铁片、同浓度的盐酸做了下列平行实验:
实验①:把纯铁片投入到盛有稀盐酸的试管中,发现放出氢气的速率变化如图所示:
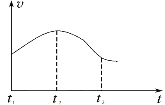
实验②:把铁片投入到含FeCl3的同浓度稀盐酸中,发现放出氢气的量减少。
实验③:在稀盐酸中滴入几滴CuCl2溶液,用铁片做实验,发现生成氢气的速率加快。
试回答下列问题:
(1)分析实验①中t1~t2速率变化的主要原因是_______,t2~t3速率变化的主要原因是______。
(2)实验②放出氢气的量减少的原因是___________________(用离子方程式表示)。
(3)某同学认为实验③反应速率加快的主要原因是形成了原电池,你认为是否正确?请选择下列相应的a或b作答。a.若不正确,请说明原因_____________________________________。b.若正确,则写出实验③中原电池的正极电极反应式_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com