
【题目】过氧化钠与铝粉混合物共18.3g,加入1L水,充分反应后混合物完全溶解,并收集到5.6L气体(标准状况下)
(1)计算生成的气体的总质量____;
(2)计算反应后溶液中各溶质的物质的量浓度(该溶液体积不变)____。
【答案】3.5g 0.3 mol/L 0.1 mol/L
【解析】
发生反应有:2Na2O2![]() 2H2O=4NaOH
2H2O=4NaOH![]() O2↑,2Al
O2↑,2Al![]() 2NaOH
2NaOH![]() 2H2O=2NaAlO2
2H2O=2NaAlO2![]() 3H2↑。
3H2↑。
(1)生成的气体为氧气与氢气,过氧化钠与Al都反应,令过氧化钠与Al的物质的量分别为x mol、y mol,根据二者质量之和及生成气体的体积之和列方程,据此计算解答;
(2)结合方程式计算判断NaOH是否完全反应、生成偏铝酸钠的物质的量,确定NaOH物质的量,再根据![]() 计算。
计算。
(1)设过氧化钠与Al的物质的量分别为x mol、y mol,过氧化钠与Al都反应,则:![]() ,
,
xmol![]()
![]()
![]() ,
,
ymolymol ymol![]() 所以
所以 ,计算得出:
,计算得出:![]() ,
,![]() ,即混合物中由过氧化钠0.2mol,铝0.1mpl,由上述反应可知,生成O2为0.5x=0.1mol,m(O2)=0.1mol
,即混合物中由过氧化钠0.2mol,铝0.1mpl,由上述反应可知,生成O2为0.5x=0.1mol,m(O2)=0.1mol![]() 32g/mol=3.2g,生成H2为1.5y=0.15mol,m(H2)=0.15mol
32g/mol=3.2g,生成H2为1.5y=0.15mol,m(H2)=0.15mol![]() 2g/mol=0.3g,所以共生成气体3.5g;
2g/mol=0.3g,所以共生成气体3.5g;
本题答案为:3.5g。
(2)由方程式可以知道,过氧化钠反应生成氢氧化钠为0.4mol,Al反应消耗的NaOH为![]() 、生成的偏铝酸钠为
、生成的偏铝酸钠为![]() ,故溶液中氢氧化钠为0.4mol-0.1mol=0.3mol,溶液中氢氧化钠的物质的量浓度c(NaOH)=0.3mol/1L=0.3mol/L,偏铝酸钠的物质的量浓度c(NaAlO2)=0.1mol/1L=0.1mol/L,;
,故溶液中氢氧化钠为0.4mol-0.1mol=0.3mol,溶液中氢氧化钠的物质的量浓度c(NaOH)=0.3mol/1L=0.3mol/L,偏铝酸钠的物质的量浓度c(NaAlO2)=0.1mol/1L=0.1mol/L,;
本题答案为:0.3mol/L,0.1mol/L。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列表示物质变化的化学用语正确的是
A. NH3·H2O的电离方程式:NH3·H2O==NH4++OH-
B. 铁发生吸氧腐蚀的正极反应方程式:O2+2H2O+4e-==4OH-
C. 碳酸钠水解的离子方程式:CO32-+2H2O![]() 2OH-+H2CO3
2OH-+H2CO3
D. CO燃烧热的热化学方程式:2CO(g)+O2(g)=2CO2(g) △H =-566.0kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按照物质的树状分类和交叉分类,HNO3属于( )
①酸 ②氢化物 ③氧化物 ④含氧酸 ⑤难挥发性酸 ⑥一元酸 ⑦化合物 ⑧混合物
A.①②③④⑤⑥⑦
B.①④⑥⑦
C.①⑧
D.①④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】多巴胺的一种合成路线如下图所示

下列说法正确的是
A. 原料甲与苯酚互为同系物 B. 中间产物乙、丙和多巴胺都具有两性
C. 多巴胺不可能存在氨基酸类的同分异构体 D. 1mol 甲最多可以和2 mol Br2发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)按如图所示操作,充分反应后:
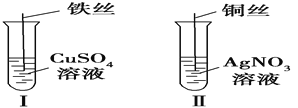
①Ⅰ中发生反应的离子方程式为___________________________________;
②Ⅱ中铜丝上观察到的现象是______________________________________
③结合Ⅰ、Ⅱ实验现象可知Fe2+、Cu2+、Ag+的氧化性由强到弱的顺序为__________。
(2)将少量Cl2通入FeCl2的溶液中,反应的离子方程式为2Fe2++Cl2===2Fe3++2Cl-,这个事实说明具有还原性的粒子还原性强弱为___________________
(3) NaHCO3溶液与足量澄清石灰水反应的离子方程式_____________________________
(4)某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。
①写出反应方程式并标出电子转移方向及数目______________________________________
②若反应方程式中转移了0.3 mol电子,则氧化产物的质量是______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将9g由CO和H2组成的混合气体在足量的O2中充分燃烧后,将生成的所有产物通过足量的Na2O2固体,Na2O2固体增加的质量为( )
A.8g B.9g C.12g D.13.5g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为一种微生物燃料电池结构示意图,关于该电池叙述正确的是( )

A. 正极反应式为![]()
B. 微生物所在电极区放电时发生还原反应
C. 放电过程中,H+从正极区移向负极区
D. 若用该电池给铅蓄电池充电,MnO2电极质量减少8.7g,则铅蓄电池负极增重9.6g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1.5 mol Cu2S和足量稀HNO3反应,生成Cu(NO3)2、H2SO4、NO和H2O。则参加反应的硝酸中被还原的硝酸的物质的量是
A. 5 mol B. 1.5 mol C. 6 mol D. 1mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com