
(Ⅰ)测定锌与稀硫酸反应的速率的方法有多种,不同的方法需要测定不同的数据。请根据你设计的测定方法,填写需要记录的数据及其单位:
① ,单位 ;
② ,单位 。
根据你测定的实验数据,处理后可求得_________(填化学式)的反应速率,单位是__________。
(Ⅱ)若某同学需要收集并测量气体体积应选下图中的 装置
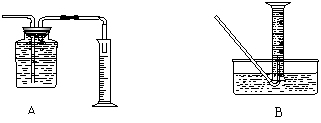 |
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:阅读理解
| 16(w-m) |
| n-w |
| 16(w-m) |
| n-w |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②⑧ | B、①②⑦ | C、③④⑥ | D、⑤⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:
测定锌与稀硫酸反应的速率。
测定该反应速率的方法有多种,不同的方法需要测定不同的数据。请根据你设计的测定方法,填写需要记录的数据及其单位:
① ,单位 ;
② ,单位 。
根据你测定的实验数据,处理后可求得_________(填化学式)的反应速率,单位是_____
_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com