
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源:2012年苏教版高中化学选修2 2.4 镁和铝的冶炼练习卷(解析版) 题型:填空题
海水中镁的总储量约为1.8×1015吨,而目前世界上利用的镁60%来自海水。如图是海水提取镁的工艺流程图。
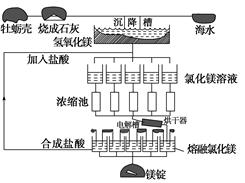
根据上面的图示,回答下列问题:
(1)请写出海水提取镁的工艺流程中属于分解反应的一个化学方程式:
________________________________________________________________________。
(2)工业上采用电解熔融MgCl2的方法制得金属镁,电解槽中阴极的电极反应式为:
________________________________________________________________________。
(3)上述制备镁的工艺流程中,适合循环经济的做法是
________________________________________________________________________。
(4)工业上制取金属铝时用电解__________(填原料)的方法,试解释铝电解槽中的阳极碳棒为何要定期更换?
________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com