
将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s)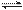 2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示:
2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示:
|
温度/℃ | 1.0 | 2.0 | 3.0 |
| 810 | 54.0 | a | b |
| 915 | c | 75.0 | d |
| 1000 | e | f | 83.0 |
下列说法错误的是:
A. b<f B. 915℃、2.0MPa时E的转化率为50%
C. 该反应的△S>0 D. K(1000℃)>K(810℃)
科目:高中化学 来源: 题型:
用3g铁粉与30ml,3mol/L的盐酸反应制取氢气,若要加快产生氢气的速率
可采取措施是( )
A.改用浓H2SO4 B.改用6mol/L的盐酸
C.改用6mol/L的HNO3 D.改用6g的铁粉
查看答案和解析>>
科目:高中化学 来源: 题型:
空气是人类生存所必需的重要资源。为改善空气质量而启动的“蓝天工程”得到了全民的支持。
下列措施不利于“蓝天工程”建设的是
A.推广使用燃煤脱硫技术,防治SO2污染
B.实施绿化工程,防治扬尘污染
C.研制开发燃料电池汽车,消除机动车尾气污染
D.加大石油、煤炭的开采速度,增加化石燃料的供应量
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组为测定一种镁铝合金中各成分的含量,现取一块3.9克该镁铝合金投入足量盐酸中,测得生成气体的体积为4.48L.计算
(1)这块合金中镁的物质的量
(2)该合金中铝元素的质量分数
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是:
A、向500mL 1 mol /LNa2CO3溶液中,滴加600mL 1 mol /LHCl 得到标况下
CO2体积为2.24L
B、电解精炼铜时,若阴极得到2摩尔电子,则阳极质量减少64克
C、将208 g BaCl2固体溶解在1 L水中,形成的溶液的浓度为1 mol·L-1
D、可用pH试纸测得氯水的酸性强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
已知电离平衡常数:H2CO3>HClO>HCO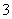 ,下列有关叙述中,正确的是:
,下列有关叙述中,正确的是:
①若KI溶液中混有Br-,加入足量FeCl3溶液,用CCl4萃取后,取无色的水层并加入AgNO3溶液,有淡黄色沉淀生成。
②向FeI2溶液中滴加少量氯水,反应的离子方程式为:2Fe2++Cl2===2Fe3++2Cl-
③向NaClO溶液中通入少量二氧化碳的离子反应方程式:
2ClO-+CO2+H2O===2HClO+CO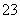
④海水提溴过程中,用碳酸钠溶液吸收溴,溴歧化为Br-和BrO3-,其离子方程式为
3 Br2+6 CO32-+3H2O=5 Br-+ BrO3-+6HCO3-
A、 ② ④ B 、 ① ③ C 、 ② ③ D、 ① ④
查看答案和解析>>
科目:高中化学 来源: 题型:
在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量。
(1)写出该反应的热化学方程式__________________________________________。
(2)已知H2O(l)====H2O(g);△H=+44kJ·mol-1,则16 g液态肼燃烧生成氮气和液态水时,放出的热量是________kJ。
(3)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是________________________。
(4)已知 N2(g)+2O2(g)====2 NO2(g);△H=+67.7 kJ·mol-1,
N2H4 (g) +O2 (g) = N2(g) +2H2O (g) △H = -543kJ/mol
根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式________________________________。
(5)已知: N2 (g) + 2O2 (g) = 2NO2 (g) △H = + 67.7kJ/mol
N2H4 (g) +O2 (g) = N2(g) +2H2O (g) △H = -543kJ/mol
1/2H2 (g) + 1/2F2 (g) = HF (g) △H = -269kJ/mol
H2 (g) + 1/2O2 (g) = H2O (g) △H = -242kJ/mol
有人认为若用氟代替二氧化氮作氧化剂,则反应释放能量更大,肼和氟反应的
热化学方程式: ________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com