
设nA为阿伏加德罗常数的数值。下列说法正确的是( )
A. 1mol 苯含有6nA个C-H键
B. 标准状况下,22.4L氨水含有nA个NH3分子
C. 18gH2O含有10nA个电子
D. 56g铁片投入足量浓H2SO4中生成nA个SO2分子
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:
美国科学家将两种元素铅和氪的原子核对撞,获得了一种质量数为293、中子数为175的超重元素,该元素原子的质子数为
A.118 B. 175 C. 47 D.293
查看答案和解析>>
科目:高中化学 来源: 题型:
某课外兴趣小组对H2O2的分解速率做了如下实验探究。
⑴ 下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:
用10mL H2O2制取150mLO2所需的时间(秒)

① 该小组在设计方案时,考虑了浓度、a: 、b: 等因素对过氧化氢分解速率的影响。
② 从上述影响H2O2分解速率的因素a和b中任选一个,说明该因素对该反应速率的影响:
。
⑵ 将质量相同但聚集状态不同的MnO2分别加入到5mL 5%的双氧水中,并用带火星的木
条测试。测定结果如下:
| 催化剂(MnO2) | 操作情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 混合不振荡 | 剧烈反应,带火星的木条复燃 | 3.5分钟 |
| 块状 | 反应较慢,火星红亮但木条未复燃 | 30分钟 |
① 写出H2O2发生的化学反应方程式 _______________ ______。
② 实验结果说明催化剂作用的大小与________ _________ 有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙两种化合物都是含X、Y两种元素,甲.乙中X元素的百分含量分别为30.4%和25.9%,若已知甲的分子式是XY2,则乙的分子式只能是( )
A.XY B.X2Y C.X2Y3 D.X2Y5
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关说法中,正确的是( )
A.分馏、干馏、裂化都是化学变化 B.聚乙烯、聚氯乙烯、纤维素都是合成高分子
C.硫酸铜、醋酸、铁都是电解质 D.盐酸、漂白粉、铝热剂都是混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
以甲苯为主要原料合成麻黄素的合成路线如下
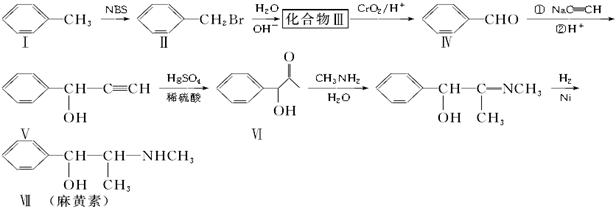
(1)化合物Ⅵ的分子式为________。
(2)化合物Ⅰ、Ⅱ、Ⅳ、Ⅴ能使Br2的CCl4溶液褪色是_______________________。
(3)化合物Ⅲ的结构简式为________,生成化合物Ⅶ的反应类型为________。
(4)在浓硫酸和加热条件下,麻黄素可以发生消去反应,该反应方程式为________________。(5)任意写出满足下列条件的化合物Ⅵ的二种同分异构体______________________。
①含一个苯环 ②无酸性,酸性条件下水解生成两种有机物 ③能发生银镜反应
(6)如何通过实验证明化合物Ⅱ分子中含有溴元素,简述实验操作:
_________________________________________________
_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学方程式可简明地体现元素及其化合物的性质。已知:氧化还原反应:
2FeCl3 + 2HI = 2FeCl2 + I2 + 2HCl; 2Co(OH)3 + 6HCl = 2CoCl2 + Cl2↑ + 6H2O
2Fe(OH)2 + I2 + 2KOH = 2Fe(OH)3 + 2KI; 3I2 + 6KOH = 5KI + KIO3 + 3H2O
复分解反应:
2HSCN + K2CO3 = 2KSCN + CO2 ↑ + H2O; KCN + CO2 + H2O = HCN + KHCO3
热分解反应:4NaClO  3NaCl + NaC
3NaCl + NaC lO4;NaClO4
lO4;NaClO4  NaCl + 2O2↑
NaCl + 2O2↑
下列说法正确是( )
A.氧化性(酸性溶液):FeCl3 > Co(OH)3 > I2
B.还原性(碱性溶液):Fe(OH)2 > I2 > KIO3
C.热稳定性:NaCl > NaClO > NaClO4
D.酸性(水溶液):H2CO3 > HSCN > HCN
查看答案和解析>>
科目:高中化学 来源: 题型:
已知分解1 mol H2O2放出热量98 kJ。在含少量I-的溶液中,H2O2分解的机理为
H2O2+I-―→H2O+IO- 慢
H2O2+IO-―→H2O+O2+I- 快
下列有关该反应的说法正确的是( )
A.反应速率与I-浓度有关
B.IO-也是该反应的催化剂
C.反应活化能等于98 kJ·mol-1
D.v(H2O2)=v(H2O)=v(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
石墨在材料领域有重要应用。某初级石墨中含SiO2(7.8%)、Al2O3(5.1%)、Fe2O3(3.1%)和MgO(0.5%)等杂质。设计的提纯与综合利用工艺如下:

(注:SiCl4的沸点为57.6 ℃,金属氯化物的沸点均高于150 ℃)
(1)向反应器中通入Cl2前,需通一段时间N2,主要目的是____________________。
(2)高温反应后,石墨中氧化物杂质均转变为相应的氯化物。气体Ⅰ中的碳氧化物主要为________。由气体Ⅱ中某物得到水玻璃的化学反应方程式为____________________________________________。
(3)步骤①为:搅拌、________。所得溶液Ⅳ中的阴离子有________。
(4)由溶液Ⅳ生成沉淀Ⅴ的总反应的离子方程式为______________________________________________,100 kg初级石墨最多可能获得Ⅴ的质量为______kg。
(5)石墨可用于自然水体中铜件的电化学防腐,完成如图防腐示意图,并作相应标注。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com