
下列有关说法中,正确的是( )
A.分馏、干馏、裂化都是化学变化 B.聚乙烯、聚氯乙烯、纤维素都是合成高分子
C.硫酸铜、醋酸、铁都是电解质 D.盐酸、漂白粉、铝热剂都是混合物
科目:高中化学 来源: 题型:
下列反应的离子方程式正确的是
A.碳酸钙与稀硝酸反应: CaCO3+2H+ = Ca2++ CO2↑+H2O
B.金属钠与水反应: 2Na +2H2O =2Na+ +2OH-+ H2↑
C.铁溶于稀硫酸中: 2Fe+6H+ = 2Fe3++3H2↑
D.氢氧化钡溶液中滴加稀硫酸:Ba2+ + SO42-=BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
哈伯因发明了用氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖。现向一密闭容器中充入1 mol N2和3 mol H2,在一定条件下使上述反应发生N2+3H2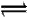 2NH3。下列说法正确的是( )
2NH3。下列说法正确的是( )
A.达到化学平衡时,N2完全转化为NH3
B.达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等
C.达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化
D.达到化学平衡时,正反应和逆反应速率都为零
查看答案和解析>>
科目:高中化学 来源: 题型:
催化剂在生产和科技领域起到重大作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
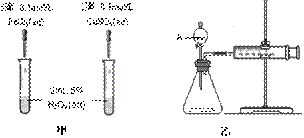
⑴ 定性分析:如图甲可通过观察 ,定性比较得出结论。同学X观察甲中两支试管产生气泡的快慢,由此得出Fe3+和Cu2+对H2O2分解的催化效果,其结论________(填“合理”或“不合理”),理由是 。
⑵ 定量分析:如图乙所示,实验时均以生成40 mL气体为准,其它可能影响实验的因素均已忽略。实验中检验气密性的方法是
,需要测量的数据是 。
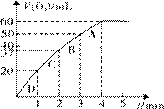 ⑶ 加入0.10 mol MnO2粉末于50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如右图所示。
⑶ 加入0.10 mol MnO2粉末于50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如右图所示。
① 实验时放出气体的总体积是 mL。
② 放出1/3气体所需时间为 min。
③ 计算H2O2的初始物质的量浓度 。 (请保留两位有效数字)
④ A、B、C、D各点反应速率快慢的顺序为_______>______>______>______。
⑤ 解释④反应速率变化的原因___ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
设nA为阿伏加德罗常数的数值。下列说法正确的是( )
A. 1mol 苯含有6nA个C-H键
B. 标准状况下,22.4L氨水含有nA个NH3分子
C. 18gH2O含有10nA个电子
D. 56g铁片投入足量浓H2SO4中生成nA个SO2分子
查看答案和解析>>
科目:高中化学 来源: 题型:
化学在生产和日常生活中有着重要的作用。下列有关说法不正确的是( )
A.我国发射的“嫦娥三号”卫星中使用的碳纤 维,是一种新型无机非金属材料
维,是一种新型无机非金属材料
B.只要 符合限量,“食用色素”“碘元素”、“亚硝酸盐”可以作为某些食品的添加剂
符合限量,“食用色素”“碘元素”、“亚硝酸盐”可以作为某些食品的添加剂
C.氢氧化铁溶胶、水玻璃、淀粉溶液均具有丁达尔效应
D.“地沟油”经过加工处理后,可以用来制肥皂和生物柴油
查看答案和解析>>
科目:高中化学 来源: 题型:
综合利用CO2对 环境保护及能源开
环境保护及能源开 发意义重大。
发意义重大。
(1)Li2O、Na2O、MgO均能吸收CO2。如果寻找吸收CO2的其他物质,下列建议合理的是 。
a. 可在酸性氧化物中寻找 
b . 可在碱性氧化物中寻找
c . 可在ⅠA、ⅡA族元素形成的
. 可在ⅠA、ⅡA族元素形成的 氧化物中寻找
氧化物中寻找
d. 可在具有强氧化性的物质中寻找
(2)Li2O吸收CO2后,产物用于合成Li4SiO4,Li4SiO4用于吸收、释放CO2。原理是: 在500℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是 。
在500℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是 。
(3)利用反应A可将释放的CO2转化为具有工业利用价值的产品。
反应A:

已知:
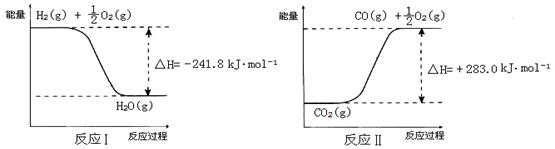
① 反应Ⅱ是_____反应(填“吸热”或“放热”)。
② 反应A的热化学方程式是 。
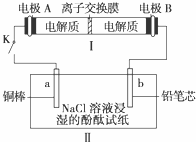 (4)如图所示装置I是一种可充电电池,装置Ⅱ为电解池。离子交换膜只允许Na+通过,充放电的化学方程式为2Na2S2+NaBr3
(4)如图所示装置I是一种可充电电池,装置Ⅱ为电解池。离子交换膜只允许Na+通过,充放电的化学方程式为2Na2S2+NaBr3  Na2S4+3NaBr 闭合开关K时,b极附近先变红色。则
Na2S4+3NaBr 闭合开关K时,b极附近先变红色。则
①负极反应式为:
②当有0.02 mol Na+通过离子交换膜时,b电极上析出的气体体积为 mL
③闭合K后,b电极附近的pH (填变大、变小或不变);
同时a电极反应式为
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B在D中充分燃烧能生成其最高价化合物BD2。E+与D2-具有相同的电子数。A在F中燃烧,产物溶于水得到一种强酸。回答下列问题:
(1)A在周期表中的位置是________,写出一种工业制备单质F的离子方程式:__________________________。
(2)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为__________,其水溶液与F单质反应的化学方程式为____________________________________________;在产物中加入少量KI,反应后加入CCl4并振荡,有机层显______色。
(3)由这些元素组成的物质,其组成和结构信息如下表:
| 物质 | 组成和结构信息 |
| a | 含有A的二元离子化合物 |
| b | 含有非极性共价键的二元离子化合物,且原子数之比为1∶1 |
| c | 化学组成为BDF2 |
| d | 只存在一种类型作用力且可导电的单质晶体 |
a的化学式为________;b的化学式为______________;c的电子式为________;d的晶体类型是________。
(4)由A和B、D元素组成的两种二元化合物形成一类新能源物质。一种化合物分子通过________键构成具有空腔的固体;另一种化合物(沼气的主要成分)分子进入该空腔,其分子的空间结构为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com