
综合利用CO2对 环境保护及能源开
环境保护及能源开 发意义重大。
发意义重大。
(1)Li2O、Na2O、MgO均能吸收CO2。如果寻找吸收CO2的其他物质,下列建议合理的是 。
a. 可在酸性氧化物中寻找 
b . 可在碱性氧化物中寻找
c . 可在ⅠA、ⅡA族元素形成的
. 可在ⅠA、ⅡA族元素形成的 氧化物中寻找
氧化物中寻找
d. 可在具有强氧化性的物质中寻找
(2)Li2O吸收CO2后,产物用于合成Li4SiO4,Li4SiO4用于吸收、释放CO2。原理是: 在500℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是 。
在500℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是 。
(3)利用反应A可将释放的CO2转化为具有工业利用价值的产品。
反应A:

已知:
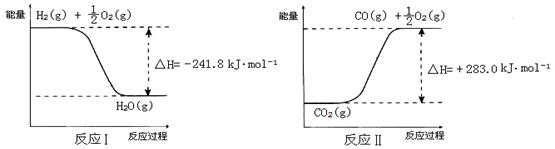
① 反应Ⅱ是_____反应(填“吸热”或“放热”)。
② 反应A的热化学方程式是 。
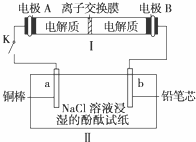 (4)如图所示装置I是一种可充电电池,装置Ⅱ为电解池。离子交换膜只允许Na+通过,充放电的化学方程式为2Na2S2+NaBr3
(4)如图所示装置I是一种可充电电池,装置Ⅱ为电解池。离子交换膜只允许Na+通过,充放电的化学方程式为2Na2S2+NaBr3 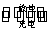 Na2S4+3NaBr 闭合开关K时,b极附近先变红色。则
Na2S4+3NaBr 闭合开关K时,b极附近先变红色。则
①负极反应式为:
②当有0.02 mol Na+通过离子交换膜时,b电极上析出的气体体积为 mL
③闭合K后,b电极附近的pH (填变大、变小或不变);
同时a电极反应式为
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
已知反应A2(g)+2B2(g)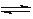 2AB2(g)△H <0,下列说法正确的
2AB2(g)△H <0,下列说法正确的
A.升高温度,正向反应速率增加,逆向反应速率减小
B.升高温度有利于反应速率增加,从而缩短达到平衡的时间
C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关说法中,正确的是( )
A.分馏、干馏、裂化都是化学变化 B.聚乙烯、聚氯乙烯、纤维素都是合成高分子
C.硫酸铜、醋酸、铁都是电解质 D.盐酸、漂白粉、铝热剂都是混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
化学方程式可简明地体现元素及其化合物的性质。已知:氧化还原反应:
2FeCl3 + 2HI = 2FeCl2 + I2 + 2HCl; 2Co(OH)3 + 6HCl = 2CoCl2 + Cl2↑ + 6H2O
2Fe(OH)2 + I2 + 2KOH = 2Fe(OH)3 + 2KI; 3I2 + 6KOH = 5KI + KIO3 + 3H2O
复分解反应:
2HSCN + K2CO3 = 2KSCN + CO2 ↑ + H2O; KCN + CO2 + H2O = HCN + KHCO3
热分解反应:4NaClO  3NaCl + NaC
3NaCl + NaC lO4;NaClO4
lO4;NaClO4  NaCl + 2O2↑
NaCl + 2O2↑
下列说法正确是( )
A.氧化性(酸性溶液):FeCl3 > Co(OH)3 > I2
B.还原性(碱性溶液):Fe(OH)2 > I2 > KIO3
C.热稳定性:NaCl > NaClO > NaClO4
D.酸性(水溶液):H2CO3 > HSCN > HCN
查看答案和解析>>
科目:高中化学 来源: 题型:
在复杂的体系中,确认化学反应先后顺序有利于解决问题,下列化学反应先后顺序判断正确的是( )
A.含等物质的量的AlO2-、OH-、CO32-的溶液中,逐滴加入盐酸:AlO2-、OH-、CO32-
B.含等物质的量的FeBr2、FeI2的溶液中 ,缓慢通入氯气:I-、Br-、Fe2+
,缓慢通入氯气:I-、Br-、Fe2+
C.含等物质的量的Ba(OH)2、KOH的溶液中,缓慢通入CO2:KOH、Ba(OH) 2、K2CO3、BaCO3
2、K2CO3、BaCO3
D.含等物质的量的Fe3+、Cu2+、H+的溶液中加入锌粉:Fe3+、Cu2+、H+、Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
已知分解1 mol H2O2放出热量98 kJ。在含少量I-的溶液中,H2O2分解的机理为
H2O2+I-―→H2O+IO- 慢
H2O2+IO-―→H2O+O2+I- 快
下列有关该反应的说法正确的是( )
A.反应速率与I-浓度有关
B.IO-也是该反应的催化剂
C.反应活化能等于98 kJ·mol-1
D.v(H2O2)=v(H2O)=v(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是________。
a.原子半径和离子半径均减小
b.金属性减弱,非金属性增强
c.氧化物对应的水化物碱性减弱,酸性增强
d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为________,氧化性最弱的简单阳离子是________。
(3)已知:
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是__________________________________;
制铝时,电解Al2O3而不电解AlCl3的原因是______________________________。
(4)晶体硅(熔点1410 ℃)是良好的半导体材料。由粗硅制纯硅过程如下:
Si(粗)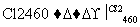 SiCl4
SiCl4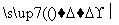 SiCl4(纯)
SiCl4(纯)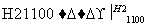 Si(纯)
Si(纯)
写出SiCl4的电子式:________________;在上述由SiCl4制纯硅的反应中,测得每生成1.12 kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:________________________________________________________________________
________________________________________________________________________。
(5)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是________。
a.NH3 b.HI c.SO2 d.CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400 ℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1。写出该反应的化学方程式:________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
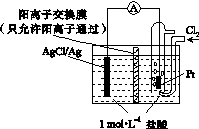
某原电池装置如下图所示,电池总反应为2Ag+Cl2===2AgCl。下列说法正确的是( )
A.正极反应为AgCl+e-===Ag+Cl-
B.放电时,交换膜右侧溶液中有大量白色沉淀生成
C.若用NaCl溶液代替盐酸,则电池总反应随之改变
D.当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
查看答案和解析>>
科目:高中化学 来源: 题型:
金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下密闭容器中用H2还原WO3可得到金属钨,其总反应为: WO3(s)+3H2(g)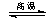 W (s) +3H2O (g)
W (s) +3H2O (g)
请回答下列问题:
⑴上述反应的化学平衡常数表达式为 。
⑵某温度下反应达到平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转 化率为 ;随着温度的升高,H2与水蒸气的体积比减小,则该反应为 反应(填“吸热”或“放热”)。
化率为 ;随着温度的升高,H2与水蒸气的体积比减小,则该反应为 反应(填“吸热”或“放热”)。
⑶上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
| 温度 | 25 ℃~550 ℃~600 ℃~700 ℃ |
| 主要成分 | WO3 W2O5 WO2 W |
第一阶段反应的化学方程式为 ;580 ℃时,固体物质的主要成分为 ;假设WO3完全转化为W,则三个阶段消耗H2物质的量之比为  。
。
⑷已知:温度过高时,WO2(s)转变为WO2(g):
WO2(s)+2H2(g)  W(s)+2H2O (g) ∆H=+66.0 kJ/mol
W(s)+2H2O (g) ∆H=+66.0 kJ/mol
WO2(g)+2H2(g)  W(s)+2H2O (g) ∆H=-137.9 kJ/mol
W(s)+2H2O (g) ∆H=-137.9 kJ/mol
则WO2(s)  WO2(g)的∆H= 。
WO2(g)的∆H= 。
⑸钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W(s)+ 2 I2 (g) 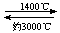 WI4 (g)。下列说法正确的有 。
WI4 (g)。下列说法正确的有 。
a.灯管内的I2可循环使用
b.WI4在灯丝上分解,产生的W又沉积在灯丝上
c.WI4在灯管壁上分解,使灯管的寿命延长
d.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com