
某原电池装置如下图所示,电池总反应为2Ag+Cl2===2AgCl。下列说法正确的是( )
A.正极反应为AgCl+e-===Ag+Cl-
B.放电时,交换膜右侧溶液中有大量白色沉淀生成
C.若用NaCl溶液代替盐酸,则电池总反应随之改变
D.当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
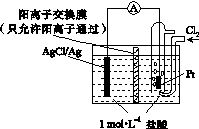
D [解析] 正极反应为Cl2+2e-===2Cl-,A项错误;放电时,交换膜右侧的电极为正极,交换膜左侧的电极为负极,负极放电产生的Ag+与电解质HCl中的Cl-结合生成AgCl白色沉淀。则负极电极反应式:2Ag-2e-+2Cl-===2AgCl,B项错误;负极放电产生的Ag+与电解质中的Cl-结合,若用NaCl代替盐酸不会改变电池总反应,C项错误;当电路中转移0.01 mol e-时,交换膜左侧的电极放电产生0.01 mol Ag+,与电解质中的0.01 mol Cl-结合生成AgCl沉淀,同时约有0.01 mol H+通过阳离子交换膜转移到右侧溶液中,则交换膜左侧溶液中约减少0.02 mol离子,D项正确。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
哈伯因发明了用氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖。现向一密闭容器中充入1 mol N2和3 mol H2,在一定条件下使上述反应发生N2+3H2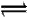 2NH3。下列说法正确的是( )
2NH3。下列说法正确的是( )
A.达到化学平衡时,N2完全转化为NH3
B.达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等
C.达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化
D.达到化学平衡时,正反应和逆反应速率都为零
查看答案和解析>>
科目:高中化学 来源: 题型:
综合利用CO2对 环境保护及能源开
环境保护及能源开 发意义重大。
发意义重大。
(1)Li2O、Na2O、MgO均能吸收CO2。如果寻找吸收CO2的其他物质,下列建议合理的是 。
a. 可在酸性氧化物中寻找 
b . 可在碱性氧化物中寻找
c . 可在ⅠA、ⅡA族元素形成的
. 可在ⅠA、ⅡA族元素形成的 氧化物中寻找
氧化物中寻找
d. 可在具有强氧化性的物质中寻找
(2)Li2O吸收CO2后,产物用于合成Li4SiO4,Li4SiO4用于吸收、释放CO2。原理是: 在500℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是 。
在500℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是 。
(3)利用反应A可将释放的CO2转化为具有工业利用价值的产品。
反应A:

已知:
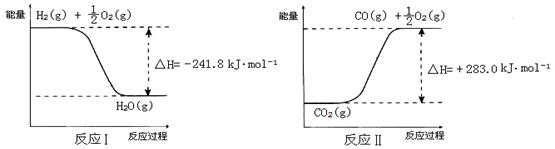
① 反应Ⅱ是_____反应(填“吸热”或“放热”)。
② 反应A的热化学方程式是 。
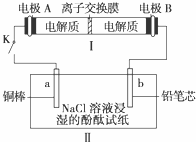 (4)如图所示装置I是一种可充电电池,装置Ⅱ为电解池。离子交换膜只允许Na+通过,充放电的化学方程式为2Na2S2+NaBr3
(4)如图所示装置I是一种可充电电池,装置Ⅱ为电解池。离子交换膜只允许Na+通过,充放电的化学方程式为2Na2S2+NaBr3  Na2S4+3NaBr 闭合开关K时,b极附近先变红色。则
Na2S4+3NaBr 闭合开关K时,b极附近先变红色。则
①负极反应式为:
②当有0.02 mol Na+通过离子交换膜时,b电极上析出的气体体积为 mL
③闭合K后,b电极附近的pH (填变大、变小或不变);
同时a电极反应式为
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:
C(s)+O2(g)===CO2(g) ΔH1
CO2(g)+C(s)===2CO(g) ΔH2
2CO(g)+O2(g)===2CO2(g) ΔH3
4Fe(s)+3O2(g)===2Fe2O3(s) ΔH4
3CO(g)+Fe2O3(s)===3CO2(g)+2Fe(s) ΔH5
下列关于上述反应焓变的判断正确的是( )
A.ΔH1>0,ΔH3<0 B.ΔH2>0,ΔH4>0
C.ΔH1=ΔH2+ΔH3 D.ΔH3=ΔH4+ΔH5
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MHNi电池)。下列有关说法不正确的是( )

A.放电时正极反应为NiOOH+H2O+e-―→Ni(OH)2+OH-
B.电池的电解液可为KOH溶液
C.充电时负极反应为MH+OH-―→H2O+M+e-
D.MH是一类储氢材料,其氢密度越大,电池的能量密度越高
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是( )
A.光催化还原水制氢比电解水制氢更节能环保、更经济
B.氨氮废水(含NH 及NH3)可用化学氧化法或电化学氧化法处理
及NH3)可用化学氧化法或电化学氧化法处理
C.某种化学检测技术具有极高的灵敏度,可检测到单个细胞(V≈10-12 L)内的数个目标分子,据此可推算该检测技术能测量细胞内浓度约为10-12~10-11mol·L-1的目标分子
D.向汽油中添加甲醇后,该混合燃料的热值不变
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B在D中充分燃烧能生成其最高价化合物BD2。E+与D2-具有相同的电子数。A在F中燃烧,产物溶于水得到一种强酸。回答下列问题:
(1)A在周期表中的位置是________,写出一种工业制备单质F的离子方程式:__________________________。
(2)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为__________,其水溶液与F单质反应的化学方程式为____________________________________________;在产物中加入少量KI,反应后加入CCl4并振荡,有机层显______色。
(3)由这些元素组成的物质,其组成和结构信息如下表:
| 物质 | 组成和结构信息 |
| a | 含有A的二元离子化合物 |
| b | 含有非极性共价键的二元离子化合物,且原子数之比为1∶1 |
| c | 化学组成为BDF2 |
| d | 只存在一种类型作用力且可导电的单质晶体 |
a的化学式为________;b的化学式为______________;c的电子式为________;d的晶体类型是________。
(4)由A和B、D元素组成的两种二元化合物形成一类新能源物质。一种化合物分子通过________键构成具有空腔的固体;另一种化合物(沼气的主要成分)分子进入该空腔,其分子的空间结构为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
NA表示阿伏加德罗常数,下列说法正确的是 ( )
A.16g CH4与18 g NH 所含质子数相等
B.1mol 苯分子中含有碳碳双键数为3NA
C.将分子总数为NA的NH3和HCl的混合气体置于标准状况下,其体积为约22. 4L
D.等物质的量的甲基(—CH3)和羟基(—OH)所含电子数相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com