
【题目】我国是世界上最早制得和使用铜、锌的国家,铜、锌及其化合物在日生产和生活中有着广泛的应用。回答下列问题:
(1)Cu在元素周期表中位于 _____(选填“s” “p” “d”或“ds” )区。在高温下CuO能分解生成Cu2O,试从原子结构角度解释其原因______________。
(2)Cu2+能与吡咯(![]() )的阴离子(
)的阴离子(![]() )形成双吡咯铜。
)形成双吡咯铜。
①![]() 中C和N原子的杂化均为________,1mol
中C和N原子的杂化均为________,1mol![]() 含有_____molσ键。
含有_____molσ键。
②双吡咯铜Cu(![]() )2中含有的化学键有_____(填编号)。
)2中含有的化学键有_____(填编号)。
A 金属键 B 极性键 C 非极性键 D 配位键 E 氢键
③噻吩(![]() )的沸点为84℃,吡咯(
)的沸点为84℃,吡咯( ![]() )的沸点在129 ~131℃之间,吡咯沸点较高,其原因是________。
)的沸点在129 ~131℃之间,吡咯沸点较高,其原因是________。
④分子中的大![]() 键可用符号
键可用符号![]() 表示,其中m代表参与形成的大
表示,其中m代表参与形成的大![]() 键原子数,n 代表参与形成的大
键原子数,n 代表参与形成的大![]() 键电子数(如苯分子中的大
键电子数(如苯分子中的大![]() 键可表示为
键可表示为![]() ),则
),则![]() 中的大
中的大![]() 键应表示为_______。
键应表示为_______。
(3)硼氢化锌[Zn ( BH4 )2 ]常用作有机合成中的还原剂,BH4-的VSEPR模型为______,与其互为等电子体的分子和阳离子有______(各写一种)。
(4)硒化锌(ZnSe)是一种半导体材料,其晶胞结构如图所示,图中X和Y点所堆积的原子均为______(填元素符号);该晶胞中硒原子所处空隙类型为 _____(填“立方体”、 “正四面体”或“正八面体” ) ;若该晶胞的参数为a pm, NA代表阿伏加德罗常数的数值,则晶胞的密度为_____ gcm-3(用相关字母的代数式表示)。
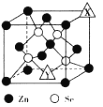
【答案】ds 外围电子排布Cu2+为3d9,而Cu+为3d10全充满更稳定 sp2 10 BCD 吡咯分子之间存在氢键 ![]() 正四面体形 CH4、NH4+ Zn 正四面体
正四面体形 CH4、NH4+ Zn 正四面体 ![]()
【解析】
(1)Cu原子核外有29个电子,基态Cu原子的核外电子排布式为[Ar]3d104s1,Cu在元素周期表中位于ds区;CuO中Cu2+的外围电子排布式为3d9,Cu2O中Cu+的外围电子排布式为3d10全充满更稳定,所以在高温下CuO能分解生成Cu2O。
(2)① ![]() 中C、N原子的价层电子对数都为3,故C和N都采取sp2杂化;1个
中C、N原子的价层电子对数都为3,故C和N都采取sp2杂化;1个![]() 中含1个N—H键、2个C—N键、4个C—H键、1个C—C键和2个C=C键,单键全为σ键,1个双键中含1个σ键和1个π键,则1个
中含1个N—H键、2个C—N键、4个C—H键、1个C—C键和2个C=C键,单键全为σ键,1个双键中含1个σ键和1个π键,则1个![]() 中含10个σ键,1mol
中含10个σ键,1mol![]() 中含10molσ键。
中含10molσ键。
②Cu(![]() )2中Cu2+与
)2中Cu2+与![]() 形成配位键,
形成配位键,![]() 中存在极性键和非极性键,答案选BCD。
中存在极性键和非极性键,答案选BCD。
③![]() 的沸点比
的沸点比![]() 高的原因是:
高的原因是:![]() 中含N—H键,吡咯分子间存在氢键,而噻吩分子间不能形成氢键。
中含N—H键,吡咯分子间存在氢键,而噻吩分子间不能形成氢键。
④![]() 中每个碳原子形成1个碳氢σ键、2个碳碳σ键或1个碳碳σ键和1个碳氮σ键,每个碳原子上还有1个单电子,N原子形成1个氮氢σ键、2个碳氮σ键,N原子上还有2个电子,则
中每个碳原子形成1个碳氢σ键、2个碳碳σ键或1个碳碳σ键和1个碳氮σ键,每个碳原子上还有1个单电子,N原子形成1个氮氢σ键、2个碳氮σ键,N原子上还有2个电子,则![]() 中5个原子(4个C和1个N)、6个电子形成大π键,可表示为
中5个原子(4个C和1个N)、6个电子形成大π键,可表示为![]() 。
。
(3)BH4-中中心原子B的价层电子对数为4+![]() =4,BH4-的VSEPR模型为正四面体形;用替代法,与BH4-互为等电子体的分子为CH4、阳离子为NH4+。
=4,BH4-的VSEPR模型为正四面体形;用替代法,与BH4-互为等电子体的分子为CH4、阳离子为NH4+。
(4)根据晶胞,Se都在晶胞内,共4个,已知的Zn为7×![]() +5×
+5×![]() ,X为1×
,X为1×![]() ,Y为1×
,Y为1×![]() ,结合化学式知,X和Y点所堆积的原子均为Zn;该晶胞中硒原子处于
,结合化学式知,X和Y点所堆积的原子均为Zn;该晶胞中硒原子处于![]() 晶胞的体心,即所处空隙类型为正四面体;晶胞参数为apm,晶胞的体积为(a×10-10cm)3=a3×10-30cm3,晶胞的质量为
晶胞的体心,即所处空隙类型为正四面体;晶胞参数为apm,晶胞的体积为(a×10-10cm)3=a3×10-30cm3,晶胞的质量为![]() g,则晶胞的密度为
g,则晶胞的密度为![]() g÷(a3×10-30cm3)=
g÷(a3×10-30cm3)=![]() g/cm3。
g/cm3。


科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)基态碳原子的核外电子排布式为______。非金属元素![]() 的第一电离能大于
的第一电离能大于![]() 的第一电离能,原因是______。
的第一电离能,原因是______。
(2)下表是第三周期部分元素的电离能[单位:[![]() (电子伏特)]数据。
(电子伏特)]数据。
元素 |
|
|
|
甲 | 5.7 | 47.4 | 71.8 |
乙 | 7.7 | 15.1 | 80.3 |
丙 | 13.0 | 23.9 | 40.0 |
丁 | 15.7 | 27.6 | 40.7 |
下列说法正确的是______(填序号)。
A.甲的金属性比乙强
B.乙有![]() 价
价
C.丙不可能为非金属元素
D.丁一定为金属元素
(3)![]() 、
、![]() 均为第四周期过渡金属元素,两元素的部分电离能数据列于下表:
均为第四周期过渡金属元素,两元素的部分电离能数据列于下表:
元素 |
|
| |
电离能/( | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
锰元素位于第四周期第ⅦB族。请写出基态![]() 的价电子排布式:______,比较两元素的I2、I3可知,气态
的价电子排布式:______,比较两元素的I2、I3可知,气态![]() 再失去1个电子比气态
再失去1个电子比气态![]() 再失去1个电子难,对此你的解释是______。
再失去1个电子难,对此你的解释是______。
(4)卤族元素![]() 、
、![]() 、
、![]() 、
、![]() 的电负性由小到大的顺序是______。
的电负性由小到大的顺序是______。
(5)基态![]() 原子的电子排布式为______;
原子的电子排布式为______;![]() 和
和![]() 相比,电负性较大的是______;
相比,电负性较大的是______;![]() 中
中![]() 元素的化合价为______。
元素的化合价为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欧美三位科学家因“分子机器的设计与合成”研究而荣获2016年诺贝尔化学奖。纳米分子机器研究进程中常见机器的“车轮”组件如下图所示。下列说法正确的是

A. ①③互为同系物 B. ①②③④均属于烃
C. ①④的一氯代物均为三种 D. ②④互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是
A. 乙酸乙酯与氢氧化钠溶液反应:CH3COOCH2CH3+OH→CH3COO+CH3CH2O+H2O
B. 醋酸溶液与新制氢氧化铜反应:2H++Cu(OH)2→Cu2++2H2O
C. 苯酚钠溶液中通入少量二氧化碳:2![]() +CO2+H2O
+CO2+H2O![]() 2
2![]() +CO
+CO![]()
D. 乙醛溶液与新制氢氧化铜碱性悬浊液共热CH3CHO+2Cu(OH)2+OH![]() CH3COO+ Cu2O↓+3H2O
CH3COO+ Cu2O↓+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家发明了一种“可固氮”的锂-氮二次电池,用可传递 Li+的醚类物质作电解质,电池的总反应为6Li +N2 ![]() 2Li3N,下列说法正确的是
2Li3N,下列说法正确的是
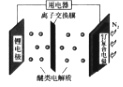
A.固氮时,电能转化为化学能
B.固氮时,电流由锂电极经用电器流向钌复合电极
C.脱氮时,钌复合电极的电极反应: 2Li3N - 6e- =6 Li++N2↑
D.脱氮时 ,Li+向钌复合电极迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚乙二醇![]() )电解质散剂,常用于肠镜检查前的肠道清洁准备。下图是以具有 芳香气味的有机物A 为原料制取聚乙二醇的过程(部分产物已略去)。烃 C 中碳与氢元素的质量比为 6∶1,是同系物中最简单的物质;E 不能发生银镜反应。
)电解质散剂,常用于肠镜检查前的肠道清洁准备。下图是以具有 芳香气味的有机物A 为原料制取聚乙二醇的过程(部分产物已略去)。烃 C 中碳与氢元素的质量比为 6∶1,是同系物中最简单的物质;E 不能发生银镜反应。
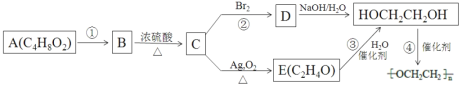
(1)E 物质的名称是_____。
(2)D 的键线式是_____。
(3)反应④的化学方程式是_____。
(4)下列说法正确的是_____。
a.A 在酸性或碱性条件下都可以反应得到B,反应②中的 Br2 可以是溴水或溴的 CCl4 溶液
b.工业上获得C 的的主要方法是催化裂化
c.可以用饱和碳酸钠溶液除去 B 中混有的少量A
d.反应①的反应类型为水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知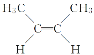 与
与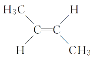 是互为“顺反异构”的同分异构体,有机化合物C4H8是生活中的重要物质,关于C4H8的说法中,错误的是( )
是互为“顺反异构”的同分异构体,有机化合物C4H8是生活中的重要物质,关于C4H8的说法中,错误的是( )
A.C4H8可能是烯烃
B.C4H8中属于烯烃的同分异构体有4种(含顺反异构)
C.C4H8中属于烯烃的顺反异构体有2种
D.核磁共振氢谱有2种吸收峰的烯烃结构一定是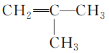
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化工生产中常用MnS作沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+MnS(s)CuS(s)+Mn2+(aq)。下列有关叙述中正确的是
A.该反应的平衡常数K=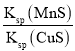
B.MnS的Ksp小于CuS的Ksp
C.达到平衡时c(Mn2+)=c(Cu2+)
D.向溶液中加入少量Na2S固体后,溶液中c(Cu2+)、c(Mn2+)保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属Co、Ni性质相似,在电子工业以及金属材料上应用十分广泛.现以含钴、镍、铝的废渣(含主要成分为CoO、Co2O3、Ni、少量杂质Al2O3)提取钴、镍的工艺如下:
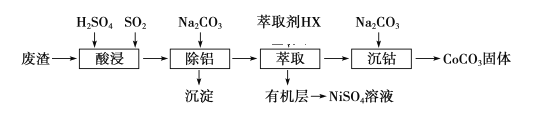
(1)酸浸时SO2的作用是___________________________________。
(2)除铝时加入碳酸钠产生沉淀的离子反应_________________________________。
(3)用CoCO3为原料采用微波水热法和常规水热法均可制得H2O2分解的高效催化剂CoxNi(1-x)Fe2O4(其中Co、Ni均为+2价).如图是用两种不同方法制得的CoxNi(1-x)Fe2O4 在10℃时催化分解6%的H2O2 溶液的相对初始速率随x 变化曲线.
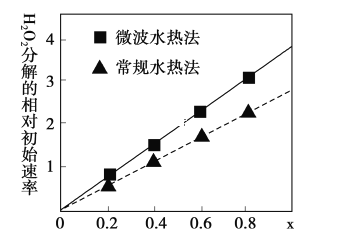
①H2O2 的电子式_________________________________。
②由图中信息可知:_________________________________法制取的催化剂活性更高。
③Co2+ 、Ni2+ 两种离子中催化效果更好的是_________________________________。
(4)已知煅烧CoCO3时,温度不同,产物不同.在400℃充分煅烧CoCO3,得到固体氧化物的质量2.41g,CO2的体积为0.672L(标况下),则此时所得固体氧化物的化学式为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com