
| A. | 31.6 g高锰酸钾完全分解产生O2的体积约为2.24 L | |
| B. | 在25℃、101KPa时,24.5L氨气所含质子数约为10NA | |
| C. | 0.3 mol•L-1硫酸钠溶液中所含Na+和SO42-总物质的量为0.9 mol | |
| D. | 25℃、101KPa下,2.24 L二氧化碳与二氧化硫的混合气体中所含氧原子数约为0.2NA |
分析 A.没有指出标准状况下,无法计算生成氧气的体积;
B.常温下气体摩尔体积约为24,5L/mol,氨气分子中含有10个质子;
C.缺少溶液体积,无法计算溶液中含有钠离子和硫酸根离子的物质的量;
D.不是标准状况下,无法计算混合气体的物质的量.
解答 解:A.不是标准状况下,不能使用标准状况下的气体摩尔体积计算,故A错误;
B.在25℃、101KPa时,24.5L氨气的物质的量为:$\frac{24.5L}{24.5L/mol}$=1mol,1mol氨气分子中含有10mol质子,所含质子数约为10NA,故B正确;
C.没有告诉硫酸钠溶液的体积,无法计算溶液中含有钠离子和硫酸根离子的物质的量,故C错误;
D.该条件不是标准状况下,不能使用标准状况下的气体摩尔体积计算,故D错误;
故选B.
点评 本题考查阿伏加德罗常数的有关计算,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确标准状况下气体摩尔体积的使用条件,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:选择题
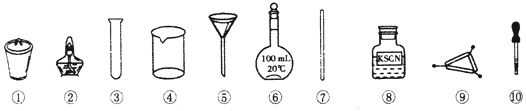
| A. | 将茶叶灼烧灰化,选用②、④和⑨ | |
| B. | 用浓硝酸溶解茶叶灰并加蒸馏水稀释,选用④和⑦ | |
| C. | 过滤得到滤液,选用④、⑤和⑦ | |
| D. | 检验滤液中的Fe3+,选用③、⑧和⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和时所需NaOH的量 | B. | 与Mg反应的起始速率 | ||
| C. | OH-的物质的量浓度 | D. | 溶液中$\frac{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
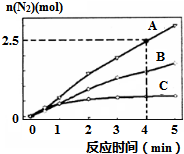 氨在生活、生产、科研中有广泛用途.
氨在生活、生产、科研中有广泛用途.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
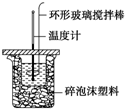 利用如图所示装置测定中和热的实验步骤如下:
利用如图所示装置测定中和热的实验步骤如下:| 实验 序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | 氢氧化钠溶液 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
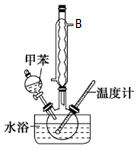 硝基甲苯有领、间、对三种,其中对硝基甲苯是医药、染料等工业的一种重要有机中间体,它常以浓硝酸为硝化剂,浓硫酸为催化剂,通过甲苯的硝化反应制备.一种新的制备对硝基甲苯的实验方法是:以发烟硝酸为硝化剂,固体NaHSO4为催化剂(可循环使用),在CCl4溶液中,加入乙酸酐(有脱水作用),45℃反应1h.反应结束后,过滤,滤液分别用5%NaHCO3,溶液、水洗至中性,再经分离提纯得到对硝基甲苯.
硝基甲苯有领、间、对三种,其中对硝基甲苯是医药、染料等工业的一种重要有机中间体,它常以浓硝酸为硝化剂,浓硫酸为催化剂,通过甲苯的硝化反应制备.一种新的制备对硝基甲苯的实验方法是:以发烟硝酸为硝化剂,固体NaHSO4为催化剂(可循环使用),在CCl4溶液中,加入乙酸酐(有脱水作用),45℃反应1h.反应结束后,过滤,滤液分别用5%NaHCO3,溶液、水洗至中性,再经分离提纯得到对硝基甲苯.| 催化剂 | n(催化剂) | 硝化产物中各种异构体质量分数(%) | 总产率 (%) | ||
| n(甲苯) | 对硝基甲苯 | 邻硝基甲苯 | 间硝基甲苯 | ||
| 浓H2SO4 | 1.0 | 35.6 | 60.2 | 4.2 | 82.0 |
| 1.2 | 36.5 | 59.2 | 4.0 | 83.8 | |
NaHSO4 | 0.25 | 46.3 | 52.8 | 0.9 | 92.8 |
| 0.32 | 48.0 | 51.7 | 0.3 | 95.0 | |
| 0.36 | 45.0 | 54.4 | 0.6 | 93.9 | |
| 密度/g•cm-3 | 沸点/℃ | 溶解性 | |
| 甲苯 | 0.866 | 110.6 | 不溶于水,易溶于硝基甲苯 |
| 对硝基甲苯 | 1.286 | 237.7 | 不溶于水,易溶于液态烃 |
| 邻硝基甲苯 | 1.162 | 222 | 不溶于水,易溶于液态烃 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 |
| A | 加热放在坩埚中的小钠块 | 钠先熔化成光亮的小球,燃烧时,火焰为黄色,燃烧后,生成淡黄色固体 |
| B | 在酒精灯上加热铝箔 | 铝箔熔化,失去光泽,熔化的铝并不滴落,好像有一层膜兜着 |
| C | 在含有酚酞的水中加入一小块钠 | 钠浮在水面上,四处游动,发出嘶嘶响声,溶液变红 |
| D | 在空气中久置的铝条放入稀硫酸溶液中 | 立刻产生大量无色气泡,铝条逐渐变细,铝条逐渐发热 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com