
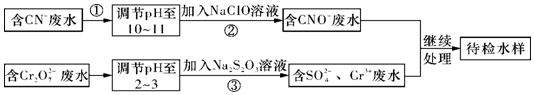
分析 由流程可知,CN-废水调整溶液pH加入NaClO溶液,氧化CN-离子反应生成CNO-的废水,含Cr2O72-的废水调整溶液pH加入Na2S2O3发生氧化还原反应得到含硫酸根离子的废水,处理的废水继续处理得到待测水样;
(1)碱性条件下,CN-离子与NaClO发生氧化还原反应生成CNO-、Cl-离子,据此写出离子方程式;
(2)Cr元素的化合价由+6价降低为+3价,结合化合价计算转移电子;
(3)Cr3+废水有毒,可使Cr3+生成沉淀过滤除去;
(4)反应后测得溶液pH=7,则可推知NaCN过量,根据电荷守恒和物料守恒即可计算出CN-和HCN的浓度,进而计算出Ka;
(5)待检水样中还有Cu2+,加碱发生Cu2++2OH-═Cu(OH)2↓,再加入Na2S溶液,CuS比Cu(OH)2更难溶,则发生沉淀的转化.
解答 解:(1)碱性条件下,CN-离子与NaClO发生氧化还原反应生成CNO-、Cl-离子,离子反应为:CN-+ClO-═CNO-+Cl-,
故答案为:CN-+ClO-═CNO-+Cl-;
(2)根据0.4 mol Cr2O72-等转化为Cr3+,铬元素化合价降低3价,0.4molCr2O72-共得到了0.4×(2×3)mol=2.4mol,故答案为:2.4;
(3)含Cr3+废水可以加入熟石灰进一步处理,目的是调节废水pH,使其转化成Cr(OH)3沉淀除去,
故答案为:调节废水pH,使其转化成Cr(OH)3沉淀除去;
(4)由于反应后测得溶液pH=7,当a=0.01时,恰好反应,生成了氰化氢溶液,溶液显示酸性,则氰化钠应该多些,故a>0.01;
故答案为:>;
(5)蓝色沉淀为Cu(OH)2,CuS(s)比Cu(OH)2(s)更难溶,发生了沉淀的转化,涉及的离子反应方程式为Cu2++2OH-═Cu(OH)2↓、Cu(OH)2(s)+S2-(aq)═CuS(s)+2OH-(aq),
故答案为:Cu2++2OH-═Cu(OH)2↓;Cu(OH)2(s)+S2-(aq)═CuS(s)+2OH-(aq).
点评 本题以污水处理流程综合考查混合物分离提纯,为高频考点,题目综合性较强,涉及氧化还原反应、离子方程式、水溶液中的离子平衡、离子浓度、电离常数、沉淀溶解平衡等电解质溶液的相关知识,侧重考查学生的知识运用能力、灵活分析处理实际问题的能力,题目难度中等.


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | π键是由两个p轨道“头碰头”重叠形成的 | |
| B. | σ键就是单键,π键就是双键 | |
| C. | 乙烷分子中的键全为σ键,而乙烯分子中含σ键和π键 | |
| D. | H2分子中含σ键,而Cl2分子中含π键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸钾和冰的熔化需克服相同类型的作用力 | |
| B. | 氢化物HA的沸点比HB高,是因为1molHA分子中的H-A键断裂时吸收的能量比1molHB分子中键断裂吸收的能量多 | |
| C. | 离子晶体在熔融状态下能导电是因为晶体受热时离子键被削弱,形成了自由移动的离子 | |
| D. | 非金属元素间只能形成共价化合物,金属和非金属元素间形成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2014年我国的冶金行业深受经济危机的冲击,尤其是Al、Fe的价格下滑幅度很大.请完成下面问题:
2014年我国的冶金行业深受经济危机的冲击,尤其是Al、Fe的价格下滑幅度很大.请完成下面问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向小苏打溶液中加入少量石灰水:HCO3-+OH-+Ca2+=CaCO3↓+2H2O | |
| B. | 向烧碱溶液中加入铝片:2Al+2OH-+2H2O=2AlO2-+3H2↑ | |
| C. | 向HI溶液中加入Fe(OH)3固体:Fe(OH)3+3H+=Fe3++3H2O | |
| D. | 向MgSO4溶液中加入Ba(OH)2溶液:Ba2++SO42--=BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应的氧化剂是 ClO- | |
| B. | 消耗 l mol 还原剂,转移电子 3 mol | |
| C. | 氧化剂与还原剂的物质的量之比为 2:3 | |
| D. | 反应后溶液的酸性明显增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com