
| A. | π键是由两个p轨道“头碰头”重叠形成的 | |
| B. | σ键就是单键,π键就是双键 | |
| C. | 乙烷分子中的键全为σ键,而乙烯分子中含σ键和π键 | |
| D. | H2分子中含σ键,而Cl2分子中含π键 |
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:选择题
| A. | 加入少量NaOH固体,平衡向正反应方向移动 | |
| B. | 加水,平衡向逆反应方向移动 | |
| C. | 滴加少量0.1mol/LHCl溶液,溶液中C(H+ )减少 | |
| D. | 加入少量CH3 C OONa固体,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液的pH等于13 | |
| B. | 加入少量NH4Cl固体,c(OH-)不变 | |
| C. | c(OH-)=c(NH4+)+c(H+) | |
| D. | 与1.0 mL 0.l mol/L盐酸混合后,溶液呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为红色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | 氯气与水反应生成HClO具有漂白性 |
| 然后溶液从无色逐渐变为浅黄绿色 | 过量氯气溶解于水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当a=1时,发生的离子反应为:OH-+H+═H2O | |
| B. | 当a=2时,发生的离子反应为:OH-+CO32-+2H+═HCO3-+H2O | |
| C. | 当1<a<2,反应后的溶液中CO32-和HCO3-的物质的量之比为:(a×10-2-0.01):(0.02-a×10-2) | |
| D. | 当a≥3时,发生的离子反应:3H++OHˉ+CO32-═2H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
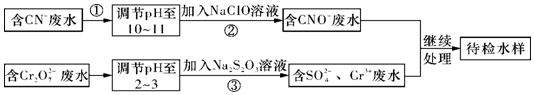
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com