
【题目】在一定温度下,在1L密闭容器中加a mol SO2和b mol O2,反应达到平衡时有c mol SO2发生了反应,试填下列空白:
(1)生成 mol SO3;
(2)O2的转化率为 ;
(3)平衡时容器内气体的总物质的量为 ;
(4)达到平衡时,c(SO2)= , c(O2)= ,c(SO3)= 。
【答案】
(1)c
(2)(50c/b)%
(3)a+b-c/2 mol
(4)a-c b-0.5c c
【解析】
试题分析:依据化学平衡三段式列式计算
2SO2+O2![]() 2SO3
2SO3
起始量(mol) a b 0
变化量(mol) c 0.5c c
平衡量(mol) a-c b-0.5c c
(1)计算可知,反应生成三氧化硫物质的量为cmol;故答案为:c;
(2)O2的转化率=![]() ×100%=
×100%=![]() %。故答案为:
%。故答案为:![]() %;
%;
(3)平衡时容器内气体总物质的量=a-c+b-0.5c+c=(a+b-![]() )mol;故答案为:(a+b-
)mol;故答案为:(a+b-![]() )mol;
)mol;
(4)达到平衡时,c(SO2)= ![]() =a-c mol/L,同理c(O2)=b-0.5c mol/L,c(SO3)=c mol/L。
=a-c mol/L,同理c(O2)=b-0.5c mol/L,c(SO3)=c mol/L。


科目:高中化学 来源: 题型:
【题目】将N2、H2的混合气体分别充入甲、乙、丙三个容器中,进行合成氨反应,经过相同的一段时间后,测得反应速率分别为:甲:v(H2)=3 mol·L-1·min-1;乙:v(N2)=2 mol·L-1·min-1;丙:v(NH3)= 1 mol·L-1·min-1。则三个容器中合成氨的反应速率
A. v(甲)>v(乙)>v(丙) B. v(乙)>v(丙)>v(甲)
C. v(丙)>v(甲)>v(乙) D. v(乙)>v(甲)>v(丙)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E是化学中常见的物质,常温下,E是一种无色无味的液体,它们之间有如下反应关系。
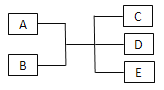
(1)若A是一种红色金属单质,B是一种常见的挥发性酸,反应时生成的C是无色气体,反应的离子方程式为___________,若反应放出1.12 L气体(标准状况下),则被还原的B物质的量为___________mol。
(2)若实验室中利用固体A和B的反应制备气体C,C是一种无色、刺激性气味、密度比空气小、碱性的气体,试写出此反应的化学方程式________________;实验室检验C的方法为_______________。
(3)若B是黄绿色有毒气体,上述关系经常用于实验室尾气处理,则反应的离子方程式为________________。若用湿润的淀粉碘化钾试纸靠近盛满B的试管口,看到的现象为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘单质在水溶液中溶解度很小,但在CCl4中溶解度很大,原因是
A.CCl4与I2分子量相差较小,而H2O与I2分子量相差较大
B.CCl4与I2都是直线型分子,而H2O不是直线型分子
C.CCl4和I2都不含氢元素,而H2O中含有氢元素
D.CCl4和I2都是非极性分子,而H2O是极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常人们把拆开1 mol某化学键所吸收的能量或形成1 mol某化学键所释放的能量看作该化学键的键能,键能的大小可用于估算化学反应的反应热(ΔH),已知
化学健 | H-H | Cl-Cl | H-Cl |
键能 | 436 kJ/mol | 243 kJ/mol | 431 kJ/mol |
化学健 | H-H | Cl-Cl | H-Cl |
键能 | 436 kJ/mol | 243 kJ/mol | 431 kJ/mol |
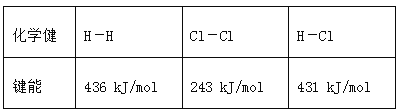
则下列热化学方程式不正确的是( )
A.![]() H2(g)+
H2(g)+ ![]() Cl2(g)===HCl(g) ΔH=+91.5 kJ·mol-1
Cl2(g)===HCl(g) ΔH=+91.5 kJ·mol-1
B.H2(g)+Cl2(g)===2HCl(g) ΔH=-183 kJ·mol-1
C.2HCl(g)===H2(g)+Cl2(g) ΔH=+183 kJ·mol-1
D.![]() H2(g)+
H2(g)+![]() Cl2(g)===HCl(g) ΔH=-91.5 kJ·mol-1
Cl2(g)===HCl(g) ΔH=-91.5 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种短周期元素,其元素特征信息如下表,回答下列问题:
元素编号 | 元素特征信息 |
A | 其单质是密度最小的物质 |
B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
C | 其阳离子与B的阴离子有相同的电子层结构,且与B可以形成两种离子化合物 |
D | 其氢氧化物和氧化物都有两性,与C同周期 |
E | 与C同周期,原子半径在该周期最小 |
(1)写出下列元素的名称:C________,E________;元素E在元素周期表中的位置是__________。
(2)写出A、B、C形成的化合物M的电子式________;B和C的离子中,半径较小的是______(填离子符号 );五种原子中半径最大的是________(填元素符号 )。五种元素最高价氧化物的水化物酸性最强的是(以上填化学式)________________________________。
(3)实验测得DE3在熔融状态下不导电,则DE3中含有的化学键类型为________。
(4)D单质与M的水溶液反应的离子方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。

把与下面的元素有关性质相符的曲线的标号填入相应括号中:
①第IIA族元素的最外层电子数_____________。
②第三周期离子Na+、Mg2+、Al3+、P3-、S2-、Cl-的离子半径_______。
③第二、三周期主族元素随原子序数递增原子半径的变化___________。
(2)已知某单核粒子的结构示意图为:![]()
①当x-y=10时,该粒子为______(填“原子”、“阳离子”或“阴离子”)。
②当y=8时,若该微粒的氧化性很弱,得一个电子后变为原子,该微粒的符号是_______。
(3)已知A、B、C、D是中学化学中常见的四种10电子微粒,它们之间存在如图中转化关系。

请写出:A的化学式_______(写一种);D的化学式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列条件下,两瓶气体所含的原子数不一定相等的是
A.同质量、不同密度的C2H4和C3H6 B.同质量、不同体积的CO和N2
C.同体积、同密度的N2O和CO2 D.同压强、同体积的CO2和SO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com