
【题目】某固体混合物中,可能含有下列离子中的几种:K+、NH4+、Mg2+、Ba2+、Cl-、SO42-、CO32-,将该混合物溶于水后得澄清溶液,现取三份各100mL该溶液分别进行如下实验:
(1)在一份溶液中加入AgNO3溶液,有白色沉淀生成;
(2)在另一份溶液中加入足量的NaOH溶液并加热,收集到1.12L气体(标准状况下);
(3)在第三份溶液中加入足量的BaCl2溶液有沉淀生成,经称量其质量为6.27g,在该沉淀中 加入足量的盐酸,沉淀部分溶解,剩余固体质量为2.33g。
根据上述实验回答下列问题:
①溶液中一定不存在的离子是:_______________________________;
②溶液中一定存在的阴离子有:_______________;其物质的量浓度分别为:_____________;
③推断K+是否存在:(填“是 ”或“否”)________________,其物质的量浓度为:___________。
【答案】Ba2+、Mg2+ SO42-、CO32- 0.1mol/L、0.2mol/L 是 C(K+)≥0.1mol/L
【解析】
①加入AgNO3溶液有沉淀产生,说明溶液中可能存在Cl-、CO32-、SO42-等离子,且至少一种;
②1.12L气体为氨气,溶液中一定含有NH4+,并且物质的量为0.05mol;
③2.33g沉淀为硫酸钡,6.27g沉淀为硫酸钡和碳酸钡的混合物;根据电荷守恒,得出是否存在钾离子,以此解答该题。
①碳酸银、硫酸银、氯化银都是白色沉淀,因此实验1得到沉淀无法确定是氯化银,故实验1对Cl-是否存在的判断是:不能确定;利用实验2可知含有铵离子,利用实验3可知沉淀一定是碳酸钡和硫酸钡,即溶液中一定含有CO32-、SO42-,碳酸钡、碳酸镁、硫酸钡等都是不溶于水的沉淀,故可判知溶液一定不存在的离子是:Ba2+、Mg2+;
②结合①中分析可知溶液中一定含有的阴离子为CO32-、SO42-,由碳酸钡可溶于盐酸,硫酸钡不溶于盐酸,可推知加入盐酸后剩余2.33g固体为BaSO4,利用硫守恒可知溶液中n(SO42-)=![]() 0.01mol,c(SO42-)=
0.01mol,c(SO42-)=![]() 0.1mol/L;6.27g固体中碳酸钡的质量为6.27g-2.33g=3.94g,利用碳守恒可知溶液中n(CO32-)=
0.1mol/L;6.27g固体中碳酸钡的质量为6.27g-2.33g=3.94g,利用碳守恒可知溶液中n(CO32-)=![]() =0.02mol,c(CO32-)=
=0.02mol,c(CO32-)=![]() 0.2mol/L;
0.2mol/L;
③溶液中肯定存在的离子是NH4+、CO32-和SO42-,经计算,NH4+的物质的量为![]() 0.05 mol,利用②中分析、计算可知CO32-、SO42-的物质的量分别为0.02 mol和0.01 mol,根据电荷守恒,n(+)=n(NH4+)=0.05mol,n(-)=2n(CO32-)+2n(SO42-)=0.06mol,钾离子一定存在。若不含Cl-,则n(K+)=0.01mol,若含Cl-,则n(K+)>0.01mol,所以C(K+)≥0.1mol/L。
0.05 mol,利用②中分析、计算可知CO32-、SO42-的物质的量分别为0.02 mol和0.01 mol,根据电荷守恒,n(+)=n(NH4+)=0.05mol,n(-)=2n(CO32-)+2n(SO42-)=0.06mol,钾离子一定存在。若不含Cl-,则n(K+)=0.01mol,若含Cl-,则n(K+)>0.01mol,所以C(K+)≥0.1mol/L。


科目:高中化学 来源: 题型:
【题目】某兴趣小组以废弃的易拉罐、漂白粉、氢氧化钠等为原料制造了一种新型环保电池,并进行相关实验,如图所示。电池的总反应方程式为2Al+3ClO-+2OH-=3Cl-+2AlO![]() +H2O。下列说法正确的是
+H2O。下列说法正确的是
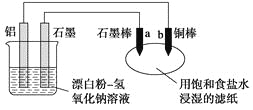
A. 电池的负极反应式为:ClO-+H2O+2e-=Cl-+2OH-
B. 当有0.1 mol Al完全溶解时,流经电解液的电子数为1.806×1023个
C. 往滤纸上滴加酚酞试液,b极附近颜色变红
D. b极附近会生成蓝色固体
查看答案和解析>>
科目:高中化学 来源: 题型:
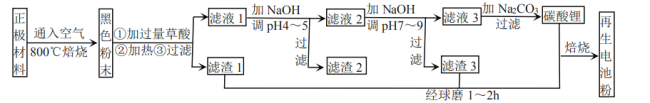
【题目】废旧锂离子电池正极材料的主要成分为碳棒和![]() ,另含少量
,另含少量![]() 、
、![]() 杂质。某厂按如图流程对废旧锂离子电池的正极进行回收再生。回答有关问题:
杂质。某厂按如图流程对废旧锂离子电池的正极进行回收再生。回答有关问题:
已知:①草酸电离常数:![]() ,
,![]() ;草酸的酸式盐以及草酸锂均可溶。
;草酸的酸式盐以及草酸锂均可溶。
②常温时,有关物质Ksp如下表(单位略):
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1)通入空气,800℃焙烧目的是___________________________。
(2)已知![]() 中
中![]() 、
、![]() 、
、![]() 化合价相同,则它们的化合价为_________。
化合价相同,则它们的化合价为_________。
(3)加入草酸加热时,![]() 、
、![]() 、
、![]() 元素部分转化为
元素部分转化为![]() 、
、![]() 、
、![]() 沉淀,而另一部分以草酸的酸式盐形式进入溶液。写出
沉淀,而另一部分以草酸的酸式盐形式进入溶液。写出![]() 与草酸反应生成
与草酸反应生成![]() 沉淀的化学方程式_________。
沉淀的化学方程式_________。
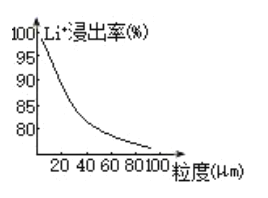
(4)焙烧后黑色粉的平均粒度(颗粒直径表示)与![]() 的浸出率关系如图所示,原因是___________。
的浸出率关系如图所示,原因是___________。
(5)滤液1加![]() 调pH为4~5目的是_____________________。
调pH为4~5目的是_____________________。
(6)滤液2调![]() 时,溶液中
时,溶液中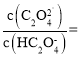 ___________。
___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸奥司他韦是临床常用的抗病毒药物,常用于甲型和乙型流感治疗。其中间体结构简式如图所示,关于该有机物下列说法错误的是( )
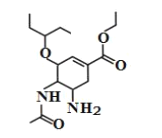
A.分子式为![]()
B.该有机物既能与酸反应又能与碱反应
C.该有机物分子中含有3个手性碳原子
D.1mol 该有机物最多能与3mol![]() 发生加成反应
发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氢呋喃是常用的有机溶剂,可由有机物A(分子式:C4H8O)通过下列路线制得
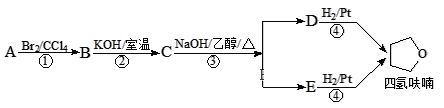
已知:R1X + R2OH![]() R1OR2 + HX
R1OR2 + HX
下列说法不正确的是
A. C中含氧官能团为醚键
B. A的结构简式是CH3CH=CHCH2OH
C. D和E均能使酸性高锰酸钾溶液褪色
D. ①③的反应类型分别为加成反应、消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,氧化反应与还原反应在同一元素间进行的是
A.Cl2 + 2NaOH = NaCl + NaClO + H2O
B.Fe + CuSO4 = FeSO4 + Cu
C.2KClO3 ![]() 2KCl + 3O2↑
2KCl + 3O2↑
D.2H2O ![]() 2H2↑+ O2↑
2H2↑+ O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属加工后的废切削液中含有2%~5%的NaNO2,它是一种环境污染物。人们用NH4Cl溶液来处理此废切削液,使亚硝酸钠转化为无毒物质。该反应分两步进行:
第一步:NaNO2+NH4Cl=NaCl+NH4NO2
第二步:NH4NO2![]() N2↑+2H2O
N2↑+2H2O
下列对第二步反应的叙述中正确的是
①NH4NO2仅是氧化剂
②NH4NO2仅是还原剂
③NH4NO2发生了分解反应
④只有氮元素的化合价发生了变化
⑤NH4NO2既是氧化剂又是还原剂
A. ①③ B. ①④
C. ②③④ D. ③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】36.5 g HCl溶解在1 L水中(水的密度近似为1 g·mL-1),所得溶液的密度为ρ g·mL-1,质量分数为w,物质的量浓度为c mol·L-1,NA表示阿伏加德罗常数,则下列叙述中正确的是( )
A. 所得溶液的物质的量浓度为1 mol·L-1
B. 所得溶液中含有NA个HCl分子
C. 36.5 g HCl气体占有的体积为22.4 L
D. 所得溶液的质量分数:w=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,实验测得1.0mol/L NH4HCO3 溶液pH=8.0。平衡时碳的分布系数(各含碳微粒的浓度占含碳各种微粒浓度之和的分数)与pH的关系如图所示。下列说法正确的是( )
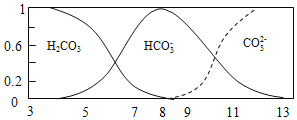
A. 常温下,Kb(NH3H2O)>Ka1(H2CO3)>Ka2(H2CO3)
B. pH=13时,溶液中不存在HCO3-的水解平衡
C. pH由8~11 时,随着pH值的增大,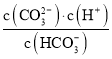 增大
增大
D. pH=3时,有c(NH4+)+c(NH3H2O)=c(HCO3-)+c(H2CO3)+c(CO32-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com