
| m |
| M |
| m |
| M |
| 28g |
| 28g/mol |
| 60g |
| 30g/mol |
| 28g+60g |
| 1mol+2mol |
| 22 g |
| 29.3g/mol |
| 1g |
| 23g/mol |
| 1 |
| 23 |
| 1 |
| 23 |
| 1 |
| 23 |
| 1g |
| 24g/mol |
| 1 |
| 24 |
| 1 |
| 24 |
| 1 |
| 12 |
| 1g |
| 27g/mol |
| 1 |
| 27 |
| 1 |
| 27 |
| 1 |
| 9 |
| 1 |
| 23 |
| 1 |
| 12 |
| 1 |
| 9 |


科目:高中化学 来源: 题型:
| A、用HNO2溶液作导电试验,灯光较暗 |
| B、HNO2是共价化合物 |
| C、亚硝酸不与氯化钠反应 |
| D、常温下0.1mol?L-1亚硝酸溶液的c(H+)为7.1×10-3mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe3+、Na+、Cl-、SCN- | ||
B、HCO3-、Ca2+、C
| ||
| C、Na+、AlO2-、NO3-、H+ | ||
| D、K+、Na+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 元素周期表是学习化学的一种重要工具.A、B、C、D、E、F是周期表中前四周期的六种元素,原子序数依次增大,其中A和B同周期,固态的AB2能升华;C和E原子都有一个未成对电子,C+比E少一个电子层,E原子得到一个电子后3p轨道全充满;D最高价氧化物中D的质量分数为40%,且核内质子数等于中子数;F有+1、+2两种常见的化合价,其单质为红色.回答下列问题:
元素周期表是学习化学的一种重要工具.A、B、C、D、E、F是周期表中前四周期的六种元素,原子序数依次增大,其中A和B同周期,固态的AB2能升华;C和E原子都有一个未成对电子,C+比E少一个电子层,E原子得到一个电子后3p轨道全充满;D最高价氧化物中D的质量分数为40%,且核内质子数等于中子数;F有+1、+2两种常见的化合价,其单质为红色.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | HA物质的量浓度(mol?L-1) | NaOH物质的量浓度(mol?L-1) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
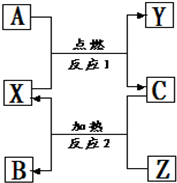 A、B、C是中学化学常见的单质,X、Y、Z是中学化学常见的氧化物,它们之间有如右图所示的转化关系,请据图回答:
A、B、C是中学化学常见的单质,X、Y、Z是中学化学常见的氧化物,它们之间有如右图所示的转化关系,请据图回答:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① | ② | ③ | ④ |
| 0.1mol?L-1氨水 | Ph=11 氨水 |
0.1mol?L-1 盐酸 |
pH=3 盐酸 |
| A、由水电离出的c(H+):③>① |
| B、①稀释到原来的100倍,pH与②相同 |
| C、①与③混合,若溶液pH=7,则溶液中c(NH4+)>C(Cl-) |
| D、②与④等体积混合,混合液pH>7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com