

分析 (1)依据热化学方程式和盖斯定律计算,[(①-②×$\frac{1}{2}$)×3+③]×2得到所需热化学方程式;
(2)①根据反应在10小时内二氧化碳的转化率计算出消耗二氧化碳的物质的量浓度,再计算出用二氧化碳表示的平均反应速率,最后根据反应速率与化学计量数的关系计算出用氢气表示的反应速率,催化剂加快反应速率,达到平衡所需时间短;
②分析图象数据结合化学平衡三段式列式计算,体积分数=物质的量的分数=$\frac{甲醇物质的量}{平衡混合气体总物质的量}$×100%,平衡常数等于平衡状态生成物平衡浓度除以反应物平衡浓度;
③计算此时的浓度商和平衡常数比较分析判断平衡移动方向,两种反应物增大一种物质会提高另一种物质的转化率.
解答 解:(1)①C(s)+1/2O2(g)=CO(g)△H1=-110.4KJ/mo1
②C(s)+O2(g)=CO2(g)△H2=-393.5kJ/mol
③Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H3=-26.7KJ/mo1
依据盖斯定律[(①-②×$\frac{1}{2}$)×3+③]×2得到,Fe2O3与C(s)反应生成Fe(s)和CO2(g)的热化学方程式为:2Fe2O3+3C(s)=4Fe(s)+3CO2(g)△H=464.7KJ/mol,
故答案为:2Fe2O3+3C(s)=4Fe(s)+3CO2(g)△H=464.7KJ/mol;
(2)①用催化剂I时,反应在10小时内二氧化碳的转化率为0.18,二氧化碳的浓度变化为:1.00mol•L-1×0.18=0.18mol/L,则反应在10小时内二氧化碳的平均反应速率为:v(CO2)=$\frac{0.18mol/L}{10h}$=0.018mol•(L•h)-1,则v(H2)=3v(CO2)=0.054mol•(L•h)-1,达到平衡M时催化剂I需要的时间长,则两个容器中的正反应速率催化剂I<催化剂Ⅱ,
故答案为:0.054,<;
②反应为CO2(g)+3H2(g)?CH3OH(g)+H2O(g),结合化学平衡三段式列式,平衡时二氧化碳转化率为20%,反应的二氧化碳物质的量=20%×1mol/L×2=0.4mol,
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
起始量(mol) 2 3.2 0 0
变化量(mol) 0.4 1.2 0.4 0.4
平衡量(mol) 1.6 2 0.4 0.4
甲醇的体积分数=$\frac{0.4mol}{(1.6+2+0.4+0.4)mol}$×100%=9.10%
平衡常数=$\frac{\frac{0.4}{2}×\frac{0.4}{2}}{\frac{1.6}{2}×(\frac{2}{2})^{3}}$=0.05
故答案为:9.10%,0.05;
③若继续向上述平衡体系M中通入0.4molCO2和0.4mol甲醇,此时浓度商=$\frac{\frac{0.4}{2}×\frac{0.4+0.4}{2}}{\frac{1.6+0.4}{2}×(\frac{2}{2})^{3}}$=0.08>K=0.05,平衡逆向进行,若继续向上述平衡体系M中通入0.8molCO2和0.4molH2O,两种反应物增大一种物质会提高另一种物质的转化率,氢气浓度减小,达到平衡时得到H2的浓度amol/>bmol/L,
故答案为:逆向,>.
点评 本题考查了热化学方程式书写和盖斯定律的计算应用,化学平衡的计算应用,平衡常数的计算应用是解题关键,题目难度中等.


科目:高中化学 来源: 题型:多选题
| A. | 1:1:1 | B. | 2:1:1 | C. | 1:2:1 | D. | 1:1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

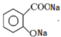
| 试剂 | 沸点(℃) | 溶解度 | 化学性质 |
| 乙酸酐 | 139 | 在水中逐渐分解 | 略 |
| 乙酰水杨酸 | 略 | 微溶于水 | 与碳酸钠反应生成水溶性盐 |
| 水杨酸 | 211 | 微溶于冷水,易溶于热水 | 略 |
| 乙酸 | 117.9 | 略 | 略 |
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.4molH2O | B. | 0.2mol H2SO4 | C. | 0.8molHCl | D. | 0.3molHNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L lmol•L-1 FeBr2溶液与lmol氯气反应时转移的电子数为3NA | |
| B. | 0.5 mol•L-1硫酸钠溶液中含有溶质离子总数为1.5NA | |
| C. | 1mol硫酸氢钠固体中含阳离子总数NA | |
| D. | 28g由乙烯和聚乙烯组成的混合气体中含有碳碳双键数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,H的化学式为KHCO3;
,H的化学式为KHCO3;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸中加入铜粉:Cu+2H+═Cu2++H2↑ | |
| B. | 用FeCl3溶液刻蚀铜制印刷电路板:Cu+Fe3+═Cu2++Fe2+ | |
| C. | 向氢氧化钠溶液中通入过量CO2:CO2+2OH-═CO32-+H2O | |
| D. | 硫酸铝溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的电池,其构造如图所示.两均为多孔碳制成,通入的气体由空隙中流出,并从电极表面放出.
美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的电池,其构造如图所示.两均为多孔碳制成,通入的气体由空隙中流出,并从电极表面放出.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com