
| A. | 常温常压下,28gN2含有的原子数为2NA | |
| B. | 1mol•L-1AlCl3溶液中含有的Cl-数为3NA | |
| C. | 标准情况下,2.24LCCl4含有的分子数NA | |
| D. | 常温常压下,22.4LCl2与足量铁充分反应,转移电子数为2NA |
分析 A.根据n=$\frac{m}{M}$计算出氮气的物质的量,再计算出含有氮原子的数目;
B.缺少溶液体积,无法计算溶液中氯离子的数目;
C.标准状况下,四氯化碳为液体,不是气体;
D.常温常压下,不能使用标况下的气体摩尔体积计算氯气的物质的量.
解答 解:A.28g氮气的物质的量为:$\frac{28g}{28g/mol}$=1mol,1mol氮气分子中含有2mol氮原子,含有的原子数为2NA,故A正确;
B.没有告诉1mol•L-1AlCl3溶液的体积,无法计算溶液中含有氯离子的物质的量及数目,故B错误;
C.标况下四氯化碳不是气体,不能使用标况下的气体摩尔体积计算,故C错误;
D.不是标况下,不能使用标况下的气体摩尔体积计算22.4L氯气的物质的量,故D错误;
故选A.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,试题侧重考查标况下气体摩尔体积的使用条件,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确标况下气体摩尔体积的使用条件:标况下、气体.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:解答题
| 步骤 | 实验操作 | 现象记录 |
| 1 | 将1g细铜丝放入盛有10mL1mol•L-1HNO3的试管中加热 | 铜丝表面有无色气体逸出,溶液变成天蓝色 |
| 2 | 将1g细铜丝放入盛有10mL的14mol•L-1HNO3的试管中 | 产生大量红棕色气体,溶液变为绿色,绿色由深到浅,未见到蓝色. |
| 3 | 将硝酸铜晶体配成饱和溶液 | 深蓝色溶液 |
| 4 | 向饱和的硝酸铜溶液中不断滴加14mol•L-1HNO3 | 溶液仍呈深蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
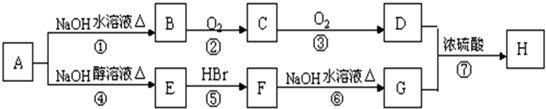
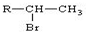 (R为烃基)
(R为烃基)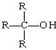 不能发生催化氧化反应.
不能发生催化氧化反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的N2和CO所含分子数均为NA | |
| B. | 2NA个HCl分子与44.8LH2和Cl2的混合气体所含的原子数目均为4NA | |
| C. | 32gCu将浓、稀硝酸分别还原为NO2和NO,浓、稀硝酸得到的电子数均为NA | |
| D. | 常温常压下,1mol氦气含有核外电子数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .A的一种晶体的晶胞如图1甲,乙图中
.A的一种晶体的晶胞如图1甲,乙图中 和
和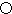 表示的是同种原子,即乙是8个甲无隙并置的结果,若按甲图中虚线方向切乙,得到图2的a~d,图中正确的是a.
表示的是同种原子,即乙是8个甲无隙并置的结果,若按甲图中虚线方向切乙,得到图2的a~d,图中正确的是a.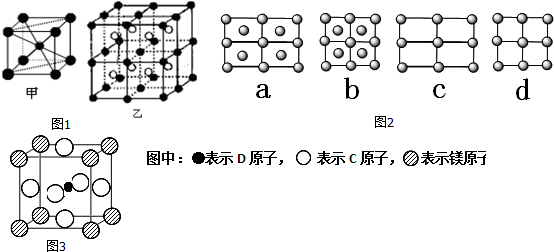
 . 据报道,只含镁、C和D三种元素的晶体竟然具有超导性.该晶体的结构(如图3示)可看作由镁原子和C原子在一起进行面心立方密堆积,该晶体的化学式为MgCNi3.晶体中每个
. 据报道,只含镁、C和D三种元素的晶体竟然具有超导性.该晶体的结构(如图3示)可看作由镁原子和C原子在一起进行面心立方密堆积,该晶体的化学式为MgCNi3.晶体中每个 原子周围距离最近的
原子周围距离最近的 原子有12个.
原子有12个.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
; ;
; (写出名称):苯甲醇
(写出名称):苯甲醇 (写出单体的结构简式)CH3COOCH=CH2
(写出单体的结构简式)CH3COOCH=CH2 (写出单体的结构简式)
(写出单体的结构简式) 、HO-CH2-CH2-CH2-CH2-OH.
、HO-CH2-CH2-CH2-CH2-OH.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
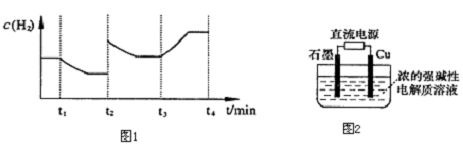
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| N2 | O2 | Ar | CO2 |
| -196°C | -183°C | -186°C | -78°C |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
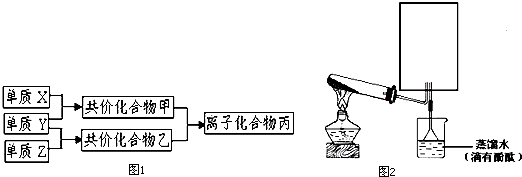
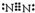 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com