
【题目】某废旧电池材料的主要成分为钴酸锂![]() ,还含有一定量的铁、铝、铜等元素的化合物,其回收工艺如图所示,最终可得到
,还含有一定量的铁、铝、铜等元素的化合物,其回收工艺如图所示,最终可得到![]() 和锂盐。
和锂盐。

已知:CoC2O4·2H2O微溶于水,它的溶解度随温度升高而逐渐增大,且能与过量的![]() 离子生成
离子生成![]() 而溶解。
而溶解。
(1)“还原酸浸”过程中,![]() 发生反应的离子方程式为:_______________________________________,该过程温度通常控制在
发生反应的离子方程式为:_______________________________________,该过程温度通常控制在![]() 以下的原因是:______________________________________。
以下的原因是:______________________________________。
(2)“除铝铁”过程的两种试剂的作用分别是________________________,____________________________。
(3)“除铜”所用试剂X为![]() ,试写出该反应的离子方程式:_______________________________。
,试写出该反应的离子方程式:_______________________________。
(4)“沉钴”过程中,![]() 的加入量
的加入量![]() 图
图![]() 、沉淀反应的温度
、沉淀反应的温度![]() 图
图![]() 与钴的沉淀率关系如下图所示:
与钴的沉淀率关系如下图所示:
![]() 随
随![]() :
:![]() 比值的增加,钴的沉淀率先逐渐增大后又逐渐减小的原因_____________________。
比值的增加,钴的沉淀率先逐渐增大后又逐渐减小的原因_____________________。
![]() 沉淀反应时间为10min,温度在
沉淀反应时间为10min,温度在![]() 以上时,随温度升高而钴的沉淀率下降的可能原因是___________________________________________。
以上时,随温度升高而钴的沉淀率下降的可能原因是___________________________________________。

(5)已知“沉锂”过程中,滤液a中的![]() 约为10-1mol/L,部分锂盐的溶解度数据如下表所示。
约为10-1mol/L,部分锂盐的溶解度数据如下表所示。
温度 | Li2SO4 | Li2CO3 |
0℃ | 36.1g | 1.33g |
100℃ | 24.0g | 0.72g |
结合数据分析,沉锂过程所用的试剂b是__________![]() 写化学式
写化学式![]() ,检验沉淀洗净的方法是___________________________________________________________。
,检验沉淀洗净的方法是___________________________________________________________。
【答案】![]() 防止
防止![]() 受热分解 将
受热分解 将![]() 氧化为
氧化为![]() 调节溶液pH,促进水解除去
调节溶液pH,促进水解除去![]() 和
和![]()
![]() 过量的
过量的![]() 离子生成
离子生成![]() 而溶解
而溶解 ![]() 的溶解度随温度升高而逐渐增大
的溶解度随温度升高而逐渐增大 ![]() 取最后一次洗涤液,加稀盐酸酸化,再加入
取最后一次洗涤液,加稀盐酸酸化,再加入![]() 溶液,若无沉淀则已洗净。
溶液,若无沉淀则已洗净。
【解析】
酸性溶液中,在过氧化氢的还原作用下![]() 转化为
转化为![]() ,在“还原酸浸”过程中,难溶于水的
,在“还原酸浸”过程中,难溶于水的![]() 转化为
转化为![]() 后,除铝铁过程使用
后,除铝铁过程使用![]() 可将
可将![]() 氧化为
氧化为![]() ,
,![]() 溶液呈碱性,可调节溶液pH,除铜过程中铜离子与硫化氢反应生成硫化铜沉淀,之后沉锂过程使用
溶液呈碱性,可调节溶液pH,除铜过程中铜离子与硫化氢反应生成硫化铜沉淀,之后沉锂过程使用![]() ,最终沉淀洗涤干净进行煅烧。
,最终沉淀洗涤干净进行煅烧。
(1)酸性溶液中,在过氧化氢的还原作用下![]() 转化为
转化为![]() ,在“还原酸浸”过程中,难溶于水的
,在“还原酸浸”过程中,难溶于水的![]() 转化为
转化为![]() 的离子反应方程式为:
的离子反应方程式为:![]() ;此过程中温度过高会使过氧化氢分解,所以温度通常控制在
;此过程中温度过高会使过氧化氢分解,所以温度通常控制在![]() 以下,故答案为:
以下,故答案为:![]() ;防止
;防止![]() 受热分解;
受热分解;
(2) “除铝铁”过程的![]() 可将
可将![]() 氧化为
氧化为![]() ,
,![]() 溶液呈碱性,可调节溶液pH,促进水解除去
溶液呈碱性,可调节溶液pH,促进水解除去![]() 和
和![]() ,故答案为:将
,故答案为:将![]() 氧化为
氧化为![]() ;调节溶液pH,促进水解除去
;调节溶液pH,促进水解除去![]() 和
和![]() ;
;
(3)铜离子与硫化氢反应生成硫化铜沉淀,离子方程式为:![]() ,故答案为:
,故答案为:![]() ;
;
(4)①由于过量的![]() 离子生成
离子生成![]() 而溶解,所以随
而溶解,所以随![]() :
:![]() 比值的增加,钴的沉淀率先逐渐增大后又逐渐减小,故答案为:过量的
比值的增加,钴的沉淀率先逐渐增大后又逐渐减小,故答案为:过量的![]() 离子生成
离子生成![]() 而溶解;
而溶解;
![]() 沉淀反应时间为10min,CoC2O4·2H2O的溶解度随温度升高而逐渐增大,所以温度在
沉淀反应时间为10min,CoC2O4·2H2O的溶解度随温度升高而逐渐增大,所以温度在![]() 以上时,随温度升高而钴的沉淀率下降,故答案为:CoC2O4·2H2O的溶解度随温度升高而逐渐增大;
以上时,随温度升高而钴的沉淀率下降,故答案为:CoC2O4·2H2O的溶解度随温度升高而逐渐增大;
![]() 相同温度下,
相同温度下,![]() 的溶解度小于
的溶解度小于![]() 的溶解度,所以沉锂过程所用的试剂b是
的溶解度,所以沉锂过程所用的试剂b是![]() ;洗涤沉淀液中若不含硫酸根离子,则沉淀洗涤干净,所以检验沉淀洗净的方法是取最后一次洗涤液,加稀盐酸酸化,再加入
;洗涤沉淀液中若不含硫酸根离子,则沉淀洗涤干净,所以检验沉淀洗净的方法是取最后一次洗涤液,加稀盐酸酸化,再加入![]() 溶液,若无沉淀则已洗净,故答案为:
溶液,若无沉淀则已洗净,故答案为:![]() ;取最后一次洗涤液,加稀盐酸酸化,再加入
;取最后一次洗涤液,加稀盐酸酸化,再加入![]() 溶液,若无沉淀则已洗净。
溶液,若无沉淀则已洗净。


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】三氯异氰尿酸是一种极强的氧化剂和氯化剂,利用氰尿酸(图1)与次氯酸在一定pH下反应可制备三氯异氰尿酸(图2),若原料完全反应生成三氯异氰尿酸,下列说法正确的是
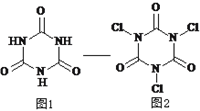
A. 氰尿酸的分子式为C6N3O3H3
B. HClO的电子式为 ![]()
C. 该转化过程有机物发生还原反应
D. 氰尿酸和次氯酸反应的物质的量之比为2 : 3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. ![]() 和
和 ![]() 均是芳香烃,
均是芳香烃,![]() 既是芳香烃又是芳香化合物
既是芳香烃又是芳香化合物
B. 1-丁烯的键线式:![]()
C. ![]() 和
和![]() 分子组成相差一个—CH2—,因此是同系物关系
分子组成相差一个—CH2—,因此是同系物关系
D. 丙烷分子的比例模型为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)有机物系统命名:
![]() ________________________________;
________________________________;
![]() ___________________________________;
___________________________________;
 ________________________________
________________________________
(2)已知有机物降冰片二烯的分子结构可表示为:
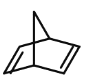
①降冰片二烯的分子式为 ______________;
②降冰片二烯属于 _________________;
a 环烃 b 不饱和烃 c 烷烃 d 烯烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中模拟工业制取NaHCO3的实验步骤如下:
第一步:连接好装置,检验气密性,在仪器内装入药品。
第二步:先让某一装置发生反应,直到产生的气体不能再在C中溶解,再通入另一装置中产生的气体,片刻后,C中出现固体。继续向C中通入两种气体,直到不再有固体产生。
第三步:分离C中所得的混合物,得到NaHCO3固体。
第四步:向滤液中加入适量的某固体粉末,有NH4C1晶体析出。
(1)如图所示装置的连接顺序是:a接__;__接__;b接__(填接口编号)。

(2)A中常选用的固体反应物为___;D中应选用的液体为__。
(3)第二步中必须先让___装置先发生反应。
(4)C中用球形干燥管而不用直导管,其作用是___;装有无水CaCl2的U形管的作用是__。
(5)第三步分离出NaHCO3固体的操作是__。
(6)第四步中所加固体粉末化学式为___;所得的晶体中常含有少量的NaCl和NaHCO3(约占5%~8%),请设计一个简单的实验,证明所得晶体大部分是NH4C1。简要写出操作和现象:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,但使用过量会使人中毒。某学习小组针对亚硝酸钠设计了如下实验:
【制取NaNO2】
设计的制取装置如下图(夹持装置略去):

该小组先查阅资料知:①2NO+Na2O2 =2NaNO2;2NO2+Na2O2 =2NaNO3;
②NO能被酸性高锰酸钾氧化为NO3-,
(1)装置A中用于盛放稀硝酸的仪器名称为_______________,装置A中发生主要反应的离子方程式为_____________________________。
(2)装置D的作用是_____________________________。
(3)若无装置B,则进入装置D中的气体除N2、NO外还可能有_____________________________。
(4)甲同学检查装置气密性后进行实验,发现制得的NaNO2中混有较多的NaNO3杂质。下列可以提高NaNO2纯度的方案是____________(填字母)。
a.将B中的药品换为碱石灰 b.将稀硝酸换为浓硝酸
C.实验开始前通一段时间CO2 d.在装置A、B之间增加盛有水的洗气瓶
【测定制得样品中NaNO2的含量】
(5)该实验中需配制KMnO4标准溶液并酸化,应选择_______(填化学式)来酸化KMnO4溶液。
(6)已知:在酸性溶液中,NO2-可将MnO4-还原为Mn2+。为测定样品中亚硝酸钠的含量,该小组称取4.0 g样品溶于水配制成250 mL溶液,取25.00 mL溶液于锥形瓶中,用0.100 mol·L-1的酸性KMnO4 溶液进行滴定,消耗20.00 mL酸性KMnO4溶液。滴定过程中酸性KMnO4溶液的作用是_______________,所得样品中NaNO2的质量分数为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)硼位于ⅢA族,三卤化硼是物质结构化学的研究热点,也是重要的化工原料。三氯化硼(BCl3)可用于制取乙硼烷(B2H6),也可作有机合成的催化剂。
【查阅资料】
①BCl3的熔点为-107.3 ℃,沸点为12.5 ℃;
②2B+6HCl![]() 2BCl3↑+3H2↑;
2BCl3↑+3H2↑;
③硼与铝的性质相似,也能与氢氧化钠溶液反应。
【设计实验】 某同学设计如图所示装置制备三氯化硼:
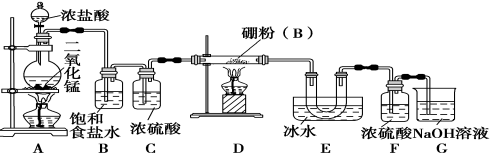
请回答下列问题:
(1)常温下,高锰酸钾固体粉末与浓盐酸发生的反应可替代A装置中的反应,两个反应的产物中锰的价态相同。写出高锰酸钾固体粉末与浓盐酸反应的离子方程式:______________。
(2)E装置的作用是________________。
(3)写出D装置中发生反应的化学方程式:__________________;实验中可以用一个盛装________(填试剂名称)的干燥管代替F+G装置,使实验更简便。
(4)三氯化硼遇水剧烈反应生成硼酸(H3BO3)和白雾,写出该反应的化学方程式________________。
(5)为了顺利完成实验,正确的操作是__________(填序号)。
①先点燃A处酒精灯,后点燃D处酒精灯
②先点燃D处酒精灯,后点燃A处酒精灯
③同时点燃A、D处酒精灯
(6)请你设计一个简易实验,验证制得的产品中是否含有硼粉:____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】油脂是重要的营养物质.某天然油脂A可发生下列反应:

已知:A的分子式为C57H106O6.1mol该天然油脂A经反应①可得到1molD、1mol不饱和脂肪酸B和2mol直链饱和脂肪酸C.经测定B的相对分子质量为280,原子个数比为C:H:O=9:16:1;
(1)写出B的分子式:________________________;
(2)写出反应①的反应类型:____________;C的名称(或俗称)是_________;
(3)近日,电视媒体关于“氢化油危害堪比杀虫剂”的报道引发轩然大波,反应②为天然油脂的氢化过程.下列有关说法不正确的是_______________;
a.氢化油又称人造奶油,通常又叫硬化油.
b.植物油经过氢化处理后会产生副产品反式脂肪酸甘油酯,摄入过多的氢化油,容易堵塞血管而导致心脑血管疾病.
c.氢化油的制备原理是在加热植物油时,加入金属催化剂,通入氢气,使液态油脂变为半固态或固态油脂.
d.油脂的氢化与油脂的皂化都属于加成反应
(4)D和足量金属钠反应的化学方程式_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】轻质碳酸钙(CaCO3)是一种重要的化工产品,广泛应用于油漆、塑料、橡胶和造纸等工业。一种以低品位石灰石(含CaCO3、MnCO3、Fe2O3及A12O3)为原料生产高纯度轻质碳酸钙的循环工艺流程如图:

回答下列问题:
(1)气体A为:______,滤渣的主要成分是______。
(2)“沉钙”过程中发生的化学反应方程式为______。
(3)在NH4C1尾液中加入氧化镁并加热,发生反应的离子方程式为______。
(4)“系列操作”包含有:______。
(5)氧化镁可以在尾液处理中循环使用,______和_______可循环使用于石灰石制备轻质碳酸钙的过程中。
(6)轻质碳酸钙的工业生产还可以使用“石灰碳化法”:用高品位石灰石焙烧制得生石灰,生石灰消化制得氢氧化钙,再通入二氧化碳制得碳酸钙;本题工艺流程与“石灰碳化法,相比,优点是:______,______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com