
【题目】按要求填空:
(1)有机物系统命名:
![]() ________________________________;
________________________________;
![]() ___________________________________;
___________________________________;
 ________________________________
________________________________
(2)已知有机物降冰片二烯的分子结构可表示为:
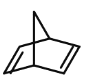
①降冰片二烯的分子式为 ______________;
②降冰片二烯属于 _________________;
a 环烃 b 不饱和烃 c 烷烃 d 烯烃
【答案】2,4-二甲基-2-己烯 苯乙烯 2-甲基戊烷 C7H8 abd
【解析】
(1)烯烃命名时,单烯烃最长的碳链有6个碳原子,从左端开始,碳碳双键的数目较小;
苯环上含有乙烯基,则名称为苯乙烯;
烷烃最长的碳链含有5个碳原子,且甲基在第二个碳原子上,名称为2甲-基戊烷;
(2) ①有机物的键线式中折点、交点均为碳原子,且每个碳原子均有4条键,不够补氢原子;
②降冰片二烯中含有碳碳双键,且含有碳环,则属于环烃、不饱和烃、烯烃。
(1)烯烃命名时,单烯烃最长的碳链有6个碳原子,从左端开始,碳碳双键的数目较小,则名称为2,4-二甲基-2-己烯;
苯环上含有乙烯基,则名称为苯乙烯;
烷烃最长的碳链含有5个碳原子,且甲基在第二个碳原子上,名称为2-甲基戊烷;
(2) ①有机物的键线式中折点、交点均为碳原子,且每个碳原子均有4条键,不够补氢原子,则分子式为C7H8;
②降冰片二烯中含有碳碳双键,且含有碳环,则属于环烃、不饱和烃、烯烃,答案为abd。


科目:高中化学 来源: 题型:
【题目】根据水解反应离子方程式的书写原则及其注意的问题,判断下列选项正确的是( )
A. FeCl3+3H2O===Fe(OH)3↓+3HCl
B. Al2S3+6H2O![]() 2Al(OH)3+3H2S
2Al(OH)3+3H2S
C. S2-+2H2O![]() H2S+2OH-
H2S+2OH-
D. HCO3-+H2O![]() H2CO3+OH-
H2CO3+OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)俗称保险粉,易被氧气氧化。利用如图装置,在锥形瓶中加入HCOONa、NaOH、CH3OH和水形成的混合液,通入SO2时发生反应生成保险粉和一种常见气体,下列说法错误的是
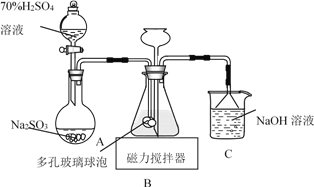
A. 制备保险粉的离子方程式为HCOO-+OH-+2SO2===S2O42-+CO2↑+H2O
B. NaOH溶液的主要作用是吸收逸出的CO2
C. 多孔玻璃球泡的作用是增大气体与溶液的接触面积,使SO2能被充分吸收
D. 为避免产生的Na2S2O4被O2氧化,使硫酸与亚硫酸钠先反应,产生的SO2排出装置中残留的O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是
A. (CH3)3C-CH=CH2与氢气完全反应后,生成2,2,3-三甲基戊烷
B. 工业上由乙烯制乙醇、苯制环己烷均属于加成反应
C. C5H11Cl的同分异构体有3种
D.  分子中所有碳原子一定在同一平面上
分子中所有碳原子一定在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸生产中,500 ℃时,NH3和O2可能发生如下反应:
①4NH3 (g)+5O2(g) ![]() 4NO(g)+6H2O(g)ΔH=-9072 kJ·mol-1 K=1.1×1026
4NO(g)+6H2O(g)ΔH=-9072 kJ·mol-1 K=1.1×1026
②4NH3(g)+4O2(g) ![]() 2N2O(g)+6H2O(g)ΔH=-1104.9 kJ·mol-1 K=4.4×1028
2N2O(g)+6H2O(g)ΔH=-1104.9 kJ·mol-1 K=4.4×1028
③4NH3(g)+3O2(g) ![]() 2N2 (g)+6H2O(g)ΔH=-1269.02 kJ·mol-1 K=7.1×1034
2N2 (g)+6H2O(g)ΔH=-1269.02 kJ·mol-1 K=7.1×1034
其中,②、③是副反应。若要减少副反应,提高单位时间内NO的产率,最合理的措施是( )
A.增大O2浓度
B.使用合适的催化剂
C.减小压强
D.降低温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C是一种合成树脂,高分子化合物,用于制备塑料和合成纤维,D是一种植物生长调节剂,用它可以催熟果实。根据以下化学反应框图填空:

(1)写出A的电子式:____________;D的结构简式为____________。
(2)写出碳化钙与水反应制取A的化学方程式: _______________________。
(3)写出由B生成C的化学方程式: __________________,其反应类型为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某废旧电池材料的主要成分为钴酸锂![]() ,还含有一定量的铁、铝、铜等元素的化合物,其回收工艺如图所示,最终可得到
,还含有一定量的铁、铝、铜等元素的化合物,其回收工艺如图所示,最终可得到![]() 和锂盐。
和锂盐。

已知:CoC2O4·2H2O微溶于水,它的溶解度随温度升高而逐渐增大,且能与过量的![]() 离子生成
离子生成![]() 而溶解。
而溶解。
(1)“还原酸浸”过程中,![]() 发生反应的离子方程式为:_______________________________________,该过程温度通常控制在
发生反应的离子方程式为:_______________________________________,该过程温度通常控制在![]() 以下的原因是:______________________________________。
以下的原因是:______________________________________。
(2)“除铝铁”过程的两种试剂的作用分别是________________________,____________________________。
(3)“除铜”所用试剂X为![]() ,试写出该反应的离子方程式:_______________________________。
,试写出该反应的离子方程式:_______________________________。
(4)“沉钴”过程中,![]() 的加入量
的加入量![]() 图
图![]() 、沉淀反应的温度
、沉淀反应的温度![]() 图
图![]() 与钴的沉淀率关系如下图所示:
与钴的沉淀率关系如下图所示:
![]() 随
随![]() :
:![]() 比值的增加,钴的沉淀率先逐渐增大后又逐渐减小的原因_____________________。
比值的增加,钴的沉淀率先逐渐增大后又逐渐减小的原因_____________________。
![]() 沉淀反应时间为10min,温度在
沉淀反应时间为10min,温度在![]() 以上时,随温度升高而钴的沉淀率下降的可能原因是___________________________________________。
以上时,随温度升高而钴的沉淀率下降的可能原因是___________________________________________。

(5)已知“沉锂”过程中,滤液a中的![]() 约为10-1mol/L,部分锂盐的溶解度数据如下表所示。
约为10-1mol/L,部分锂盐的溶解度数据如下表所示。
温度 | Li2SO4 | Li2CO3 |
0℃ | 36.1g | 1.33g |
100℃ | 24.0g | 0.72g |
结合数据分析,沉锂过程所用的试剂b是__________![]() 写化学式
写化学式![]() ,检验沉淀洗净的方法是___________________________________________________________。
,检验沉淀洗净的方法是___________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水MgBr2常用于催化剂。某化学小组在实验室选用下图所示装置 (夹持装置略)采用镁屑与液溴为原料制备无水MgBr2。

已知:①在浓硫酸存在下,加热到140℃时乙醇脱水生成乙醚(C2H5OC2H5),加热到170℃时乙醇脱水生成CH2 = CH2。
②乙醚的熔点为34.6℃,沸点为132℃。
③Mg和Br2剧烈反应,放出大量的热;MgBr2具有强吸水性;MgBr2能与乙醚发生反应 MgBr2 +3C2H5OC2H5 ![]() MgBr2 3C2H5OC2H5。
MgBr2 3C2H5OC2H5。
实验主要步骤如下:
I.选用上述部分装置,正确连接,检查装置的气密性。向装置中加入药品。
II.加热装置A,迅速升温至140℃,并保持140℃加热一段时间,停止加热。
III.通入干燥的氮气,让液溴缓慢进入装置B中,直至完全加入。
IV.装置B中反应完毕后恢复至室温,过滤反应物,将得到的滤液转移至干燥的烧瓶中,在冰水中冷却,析出晶体,再过滤得三乙醚合溴化镁粗产品。
V.用苯洗涤粗产品,减压过滤,得三乙醚合溴化镁,将其加热至160℃分解得无水 MgBr2。
回答下列问题:
(1)装置A中使用仪器m的优点是________。
(2)步骤I中所选装置的正确连接顺序是a________ (填小写字母)。装置D的作用是________。
(3)若加热装置A一段时间后发现忘记加入碎瓷片,应该采取的正确操作是________。
(4)步骤V中用苯洗涤三乙醚合溴化镁的目的是________。
(5)步骤V采用减压过滤(使容器内压强降低,以达到固液快速分离)。下列装置可用作减压过滤的是________(填序号)。

(6)实验中若温度控制不当,装置B中会产生CH2Br—CH2Br。请设计实验验证 CH2Br—CH2Br的存在:从反应后的混合物中分离提纯得到CH2Br—CH2Br,_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A(C3H6)是一种基本有机化工原料。由A制备聚合物C和![]() 的合成路线(部分反应条件略去)如图所示。
的合成路线(部分反应条件略去)如图所示。

已知:i.![]() +
+![]()
![]()
![]() ;ii.R—C≡N
;ii.R—C≡N![]() R—COOH
R—COOH
回答下列问题:
(1)A的名称是_________,B中含有的官能团的名称是____________。
(2)D→E的反应类型为_______________,![]() 可在一定条件下发生缩聚反应,得到的产物结构简式为_______________________。
可在一定条件下发生缩聚反应,得到的产物结构简式为_______________________。
(3)E→F的化学反应方程式为_______________________。
(4)B的同分异构体中,与B具有相同的官能团且能发生银镜反应,并且核磁共振氢谱为3组峰,且峰面积之比为6:1:1的是__________________________(写结构简式)。
(5)结合题中所给信息,以乙烯为起始原料制备丙酸,设计合成路线________(其他试剂任选)。合成路线流程图写法示例如下:CH3CHO![]() CH3COOH
CH3COOH![]() CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com