
【题目】(1)COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为________,中心原子的杂化方式为__________________。
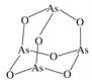
(2)As4O6的分子结构如图所示,其中As原子的杂化方式为______________。
(3)AlH4-中,Al原子的轨道杂化方式为__________;列举与AlH4-空间构型相同的一种离子和一种分子:__________、__________(填化学式)。
(4)用价层电子对互斥理论推断SnBr2分子中,Sn原子的轨道杂化方式为____________,SnBr2分子中Br-Sn-Br的键角________120°(填“>”“<”或“=”)。
【答案】3∶1 sp2 sp3 sp3 NH4+ CH4 sp2 <
【解析】
(1)根据1个单键是1个δ键,1个双键中含有1个δ键,1个π键以及COCl2分子的结构式来解答;
(2)As4O6的分子中As原子形成3个As-O键,含有1对孤对电子,杂化轨道数目为4;
(3)AlH4-中Al原子孤电子对数=![]() =0,杂化轨道数目=4+0=4;互为等电子体的微粒空间构型相同,与AlH4-空间构型相同的离子,可以用C原子替换Al原子则不带电荷,可以用N原子与1个单位正电荷替换Al原子。
=0,杂化轨道数目=4+0=4;互为等电子体的微粒空间构型相同,与AlH4-空间构型相同的离子,可以用C原子替换Al原子则不带电荷,可以用N原子与1个单位正电荷替换Al原子。
(4)先判断价层电子对数目判断杂化类型,中心原子的孤电子对对成键电子对有排斥作用进而判断分子中Sn-Br的键角。
(1)COCl2分子中有1个C=O键和2个C-Cl键,所以COCl2分子中σ键的数目为3,π键的数目为1,个数比3:1,中心原子C电子对数=3+![]() =3,故中心原子杂化方式为sp2,故答案为:3:1;sp2;
=3,故中心原子杂化方式为sp2,故答案为:3:1;sp2;
(2)As4O6的分子中As原子形成3个As-O键,含有1对孤对电子,杂化轨道数目为4,杂化类型为sp3杂化;故答案为:sp3;
(3)AlH4-中Al原子孤电子对数=![]() =0,杂化轨道数目=4+0=4,Al原子杂化方式为:sp3,互为等电子体的微粒空间构型相同,与AlH4-空间构型相同的离子,可以用C原子替换Al原子则不带电荷:CH4,可以用N原子与1个单位正电荷替换Al原子:NH4+,故答案为:sp3;NH4+;CH4;
=0,杂化轨道数目=4+0=4,Al原子杂化方式为:sp3,互为等电子体的微粒空间构型相同,与AlH4-空间构型相同的离子,可以用C原子替换Al原子则不带电荷:CH4,可以用N原子与1个单位正电荷替换Al原子:NH4+,故答案为:sp3;NH4+;CH4;
(4)SnBr2分子中Sn原子价层电子对个数=2+![]() ×(4-2×1)=3,所以Sn原子的轨道杂化方式为sp2杂化,且含有一个孤电子对,所以该分子为V形分子,孤电子对对成键电子对有排斥作用,所以其键角小于120°,故答案为:SP2杂化;<。
×(4-2×1)=3,所以Sn原子的轨道杂化方式为sp2杂化,且含有一个孤电子对,所以该分子为V形分子,孤电子对对成键电子对有排斥作用,所以其键角小于120°,故答案为:SP2杂化;<。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】表是25℃时某些弱酸的电离平衡常数,下列说法正确的是( )
化学式 | CH3COOH | HClO | H2CO3 |
Ka | 1.8×10﹣5 | 3.0×10﹣8 | Ka1=4.1×10﹣7 Ka2=5.6×10﹣11 |
A. 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是:c(Na+)>c(ClO﹣)>c(CH3COO﹣)>c(OH﹣)>c(H+)
B. 向0.1mol·L﹣1CH3COOH溶液中滴加NaOH溶液至溶液pH=5,此时溶液中c(CH3COOH):c(CH3COO﹣)=9:5
C. 少量碳酸氢钠固体加入到新制的氯水中,c(HClO)增大
D. 等体积等物质的量浓度的CH3COONa(aq)与NaClO(aq)中离子总数大小:N前<N后
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y 、Z、W是原子序数依次增大的短周期主族元素,其中Z的最外层电子数与X的核外电子总数相等。X、Z、W形成的一种化合物结构为![]() ,该物质常用于制备纳米材料以及工业催化剂。下列说法正确的是
,该物质常用于制备纳米材料以及工业催化剂。下列说法正确的是
A.元素非金属性:X>Y>Z
B.简单离子半径:Y<Z< W
C.工业上常通过电解W与Z形成的化合物制备W单质
D.简单气态氢化物的稳定性:X<Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成具有良好生物降解性的有机高分子材料是有机化学研究的重要课题之一。聚醋酸乙烯酯(PVAc)水解生成的聚乙烯醇(PVA),具有良好生物降解性,常用于生产安全玻璃夹层材料PVB。有关合成路线如图(部分反应条件和产物略去)。

已知:Ⅰ.RCHO+R’CH2CHO +H2O
+H2O
Ⅱ.![]() (R、R′可表示烃基或氢原子)
(R、R′可表示烃基或氢原子)
Ⅲ.A为饱和一元醇,其氧的质量分数约为34.8%,请回答:
(1)C中官能团的名称为_____,该分子中最多有_____个原子共平面。
(2)D与苯甲醛反应的化学方程式为_____。
(3)③的反应类型是____。
(4)PVAc的结构简式为____。
(5)写出与F具有相同官能团的同分异构体的结构简式____(任写一种)。
(6)参照上述信息,设计合成路线以溴乙烷为原料(其他无机试剂任选)合成 。____。
。____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N4分子结构为正四面体(如图所示)。己知:断裂N4(g)中1molN-N键吸收193kJ能量,形成N2(g)中1 molN≡N放出941 kJ能量。下列说法正确的是

A. 形成1 molN4(g)中的化学键放出193kJ的能量
B. N4(g)比N2(g)更稳定
C. lmolN2(g)完全转化为N4(g),体系的能量增加362kJ
D. N4(g) =2N2(g) △H=724kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾(FeSO4·7H2O)可作还原剂、着色剂、制药等,在不同温度下易分解得到各种铁的氧化物和硫的氧化物。已知SO3是一种无色晶体,熔点16.8℃,沸点44.8℃,氧化性及脱水性较浓硫酸强,能漂白某些有机染料,如品红等。回答下列问题:

(1)甲组同学按照上图所示的装置,通过实验检验绿矾的分解产物。装置B中可观察到的现象是_____________________________,甲组由此得出绿矾的分解产物中含有SO2。装置C的作用是_________________________。
(2)乙组同学认为甲组同学的实验结论不严谨,认为需要补做实验。对甲组同学做完实验的B装置的试管加热,发现褪色的品红溶液未恢复红色,则可证明绿矾分解的产物中__________(填字母)。
A.不含SO2 B.可能含SO2 C.一定含有SO3
(3)丙组同学查阅资料发现绿矾受热分解还可能有O2放出,为此,丙组同学选用甲组同学的部分装置和下图部分装置设计出了一套检验绿矾分解所得气态产物的装置:

①丙组同学的实验装置中,依次连接的合理顺序为_______________________。
②能证明绿矾分解产物中有O2的检验方法是________________________。
(4)为证明绿矾分解产物中含有三价铁的操作及现象____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】S-诱抗素制剂能保持鲜花盛开,S-诱抗素的分子结构如图,下列关于该物质说法正确的是

A.S-诱抗素制剂分子中所有碳原子不可能处于同一平面上
B.1 mol S-诱抗素制剂最多能 4 mol Br2 发生加成反应
C.在 Cu 或 Ag 做催化剂、加热条件下能被 O2 氧化为醛
D.该化合物不能发生聚合反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+B(g) ![]() 2C(g)+3D(g)在四种不同情况下的反应速率如下,其中表示
2C(g)+3D(g)在四种不同情况下的反应速率如下,其中表示
反应速率最快的是
A. v(A)=0.20mol·L-1·min-1 B. v(B)=0.30 mol·L-1·min-1
C. v(C)=0.40 mol·L-1·min-1 D. v(D)=0.50 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如下:
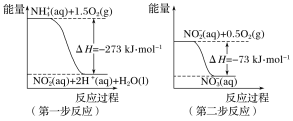
①第一步反应是________(填“放热”或“吸热”)反应,判断依据是________________。
②1molNH4+(aq)全部氧化成NO3-(aq)的热化学方程式是___________________________。
(2)已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566kJ·mol-1①
Na2O2(s)+CO2(g)=Na2CO3(s)+0.5O2(g) ΔH=-226kJ·mol-1②
则CO(g)与Na2O2(s)反应放出509kJ热量时,电子转移数目为________________。
(3)已知H2(g)+Br2(l)=2HBr(g) ΔH=-72kJ·mol-1,蒸发1molBr2(l)需要吸收的能量为30kJ,其他相关数据如下表:
物质 | H2(g) | Br2(g) | HBr(g) |
1mol分子中的化学键断裂时需要吸收的能量(kJ) | 436 | 200 | a |
则表中a=______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com