
| A. | 未用标准液润洗滴定管 | |
| B. | 盛标准液的滴定管尖嘴部分有气泡未排出就开始滴定,滴定后气泡消失 | |
| C. | 锥形瓶用蒸馏水洗,未用待测液润洗 | |
| D. | 振荡时锥形瓶中液滴飞溅出来 |
分析 根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析不当操作对相关物理量的影响,以此判断浓度的误差.
A.未用标准液润洗滴定管,标准液的浓度偏小;
B.盛标准液的滴定管尖嘴部分有气泡未排出就开始滴定,滴定后气泡消失,导致V(标)偏大;
C.锥形瓶用蒸馏水洗,未用待测液润洗,待测液的物质的量不变,对V(标)无影响;
D.振荡时锥形瓶中液滴飞溅出来,造成V(标)偏小.
解答 解:A.未用标准液润洗滴定管,标准液的浓度偏小,造成V(标准液)偏高,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$可知c(待测)偏大,故A错误;
B.滴定管装液后尖嘴部位有气泡,滴定后气泡消失,造成V(标)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$可知c(待测)偏大,故B错误;
C.锥形瓶用蒸馏水冲洗后未用待测液润洗,待测液的物质的量不变,对V(标)无影响,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$可知c(待测)不变,故C错误;
D.锥形瓶里溶液在滴定过程中溅出,待测液的物质的量偏小,造成V(标)偏小,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$可知c(待测)偏小,故D正确;
故选D.
点评 本题考查了中和滴定中的误差分析,注意锥形瓶不能润洗,滴定管必须润洗,本题难度不大,注意操作的规范性和掌握实验中常见的误差分析技巧.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | NH4Cl(s)=NH3(g)+HCl(g)室温下不能自发进行,说明该反应的△H<0 | |
| B. | 镀锡铁制品镀层破损后,铁制品比受损前更容易生锈,而镀锌铁制品则相反 | |
| C. | 将纯水加热至较高温度,K变大、pH变小、呈酸性 | |
| D. | 给0.1mol•L-1CH3COOH溶液中加热,则c(H+)与c(CH3COOH)的比值增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用NaCl配成一定物质的量浓度溶液 | B. | HCl溶于水 | ||
| C. | 水变成水蒸气 | D. | (NH4)2CO3加强热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
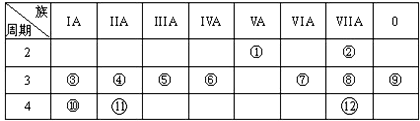
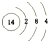 ,写出①的气态氢化物分子的电子式
,写出①的气态氢化物分子的电子式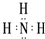 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量MgCl2、Ba(OH)2和HCl溶液混合:Mg2++3OH-+H+=Mg(OH)2↓+H2O | |
| B. | Ca(HCO3)2溶液与过量NaOH溶液反应:Ca2++HCO3-+OH-=CaCO3↓+2H2O | |
| C. | 等物质的量的FeBr2与Cl2反应为:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- | |
| D. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烯分子有8个σ键,1个π键 | |
| B. | 丙烯分子中3个碳原子都是sp3杂化 | |
| C. | 丙烯分子中只存在极性键 | |
| D. | 丙烯分子中3个碳原子在同一直线上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
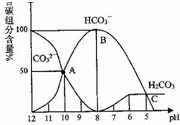 常温下,某Na2CO3溶液中含有碳组分含量(物质的量分数)随溶液的pH逐渐降低而发生变化如图,下列说法正确的是( )
常温下,某Na2CO3溶液中含有碳组分含量(物质的量分数)随溶液的pH逐渐降低而发生变化如图,下列说法正确的是( )| A. | 在滴有酚酞的Na2CO3溶液中逐滴加盐酸至溶液恰好变为无色,得到溶液 | |
| B. | 有CO2气体放出的范围是pH≤5 | |
| C. | HCO3-的电离平衡常数为1×10-4 | |
| D. | pH=11的Na2CO3溶液稀释到体积为原来的100倍后pH=9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
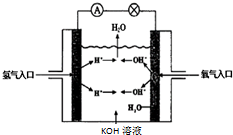 氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答下列问题:
氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com